
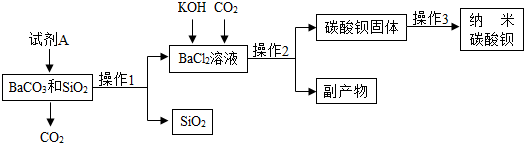
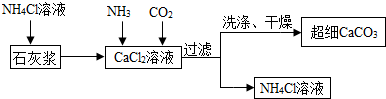
分析 (1)碳酸钡能与稀盐酸反应生成氯化钡、水、二氧化碳,根据操作1后得到氯化钡溶液,可推断向混合物中所加的试剂A可为稀盐酸;
(2)根据氢氧化钾能与二氧化碳反应生成碳酸钾和水,碳酸钾能与氯化钡反应生成碳酸钡沉淀解答;根据物质的提纯方法,为从反应后的混合溶液中分离出碳酸钡固体,应通过过滤、洗涤与烘干操作,并根据氯化钾与硝酸银可产生白色氯化银沉淀,可采取滴加硝酸银的方法检验洗涤干净;
(3)利用非金属氧化物与碱溶液的反应规律,判断二氧化硅与氢氧化钠的反应,写出反应的化学方程式;并结合除杂的操作方法,判断过程中加入氢氧化钠的量.
解答 解:(1)根据反应后生成氯化钡,由碳酸钡能与盐酸反应生成氯化钡、水、二氧化碳,可判断所加入的试剂A应为稀盐酸,故反应是碳酸钡和稀盐酸的反应;
(2)氢氧化钾能与二氧化碳反应生成碳酸钾和水,碳酸钾能与氯化钡反应生成碳酸钡沉淀;为从反应后的混合溶液中获得纯净碳酸钡,需要进行过滤,过滤后洗涤沉淀表面残留的溶液,以除去沉淀表面可溶性杂质或残留滤渣表面滤液,然后进行烘干干燥;为检验洗涤干净,利用氯化钾能与硝酸银产生白色沉淀,可向洗涤后的溶液中滴加硝酸银检验洗涤后的溶液中不再含有氯化钾,以证明洗涤干净;
(3)二氧化硅为非金属氧化物,根据这两类物质的反应特点,可知反应生成硅酸钠和水,反应的化学方程式为2NaOH+SiO2══Na2SiO3+H2O;为除去碳酸钡与二氧化硅中的二氧化硅,利用二氧化硅能与氢氧化钠溶液反应生成可溶性的硅酸钠,可向混合物中加入过量氢氧化钠溶液以完全除去二氧化硅,经过过滤,洗涤,烘干得碳酸钡固体.
故答案为:
(1)BaCO3+2HCl=BaCl2+H2O+CO2↑;
(2)2KOH+CO2=K2CO3+H2O;BaCl2+K2CO3=BaCO3↓+2KCl;干燥; 除去固体表面的KCl杂质;AgNO3;
(3)2NaOH+SiO2=Na2SiO3+H2O;NaOH.
点评 通过流程图的分析,明确生产过程中所涉及的物质性质及变化规律,体现运用知识分析问题、解决问题的能力.


科目:初中化学 来源: 题型:选择题
| A. | 制造药匙的不锈钢属于混合物 | |
| B. | 制造蒸发皿的陶瓷主要成分是硅酸鈣(CaSiO3),硅酸钙属于盐 | |
| C. | 制造棕色试剂瓶的玻璃,其主要成分为二氧化硅,玻璃属于化合物 | |
| D. | 火柴头覆盖的红色物质为红磷,红磷属于单质 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
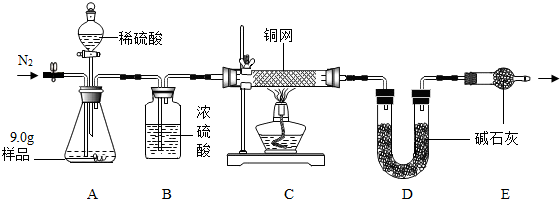
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
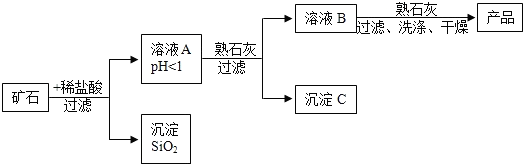
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 4.2 | 8.6 |
| 完全沉淀的pH | 3.2 | 6.7 | 11.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
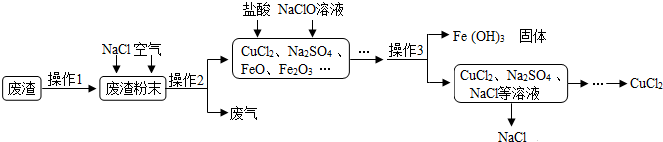
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 科学严谨的态度,安全规范的操作是成功进行化学实验的保障.
科学严谨的态度,安全规范的操作是成功进行化学实验的保障.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 不慎将水银温度计打碎洒落在桌面上,立即扫入垃圾桶中 | |
| B. | 不慎将酒精灯碰倒,洒出的酒精在桌上燃烧起来,立刻用湿布扑灭 | |
| C. | 不慎将浓硫酸沾到皮肤上,立刻用大量水冲洗,再涂上3%一5%碳酸氢钠溶液 | |
| D. | 不慎将氢氧化钠溶液沾到皮肤上,立刻用大量水冲洗,再涂上硼酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com