1909年化学家哈伯在实验室首次将氮气和氢气在一定条件下合成了氨(NH
3).常温下,氨是一种无色有刺激性气味的气体,密度小于空气,极易溶解于水,氨和氧气在铂催化剂和一定温度下反应产生一氧化氮和水.
(1)从以上信息中你能总结出氨的物理性质是
常温下,氨是一种无色有刺激性气味的气体
常温下,氨是一种无色有刺激性气味的气体
(写出一条即可);
(2)如图为实验室制取气体常使用的实验装置:

在实验室中,常用加热氯化铵(固体)和熟石灰(固体)混合物的方法制取氨气.
①采用上述方法制取氨气应选择
A
A
(填装置序号)作为气体的发生装置;
②同学们一致认为,选择C装置收集氨气不合理,理由是
氨气的密度小于空气
氨气的密度小于空气
.
③装置A除用作某些气体的发生装置外,还可进行其它实验,如
加热碳酸氢铵
加热碳酸氢铵
(请举一例加以说明).
(3)2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.

、
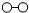
、

分别表示N
2、H
2、NH
3.在催化剂表面(下图中

表示催化剂表面)N
2和H
2反应合成氨的反应过程可用五张图表示如下:

①观察上图,可发现合成氨反应过程的顺序为:E→
D
D
→
A
A
→
B
B
→C(在括号中填写其它三张图示的序号);
②综合以上五张图示,你能总结出的有关化学反应的一条结论是:
化学反应前后,原子的种类和个数均不变
化学反应前后,原子的种类和个数均不变
.
(4)某研究性学习小组尝试利用氨气进行“微粒的基本性质”的实验探究,实验过程如下:
a.将干燥的集气瓶B充满与大气压强相等的干燥氯化氢气体并组装成如图1所示的实验装置(K
3处于关闭状态至操作b 完成为止);
b.通过调节活塞K
1、K
2,在干燥的集气瓶A中充满与大气压强相等的干燥氨气,其操作是:打开K
1、K
2,在
K1
K1
(选填“K
1”或“K
2”)处导管口通入干燥的氨气;
c.集满氨气后,关闭K
1、K
2,再打开K
3,一段时间后两只集气瓶中都出现白烟(氯化氢气体与氨气反应产生氯化铵固体的细小颗粒).
①写出c步实验中所发生的反应的化学式表达式
NH3+HCl=NH4Cl
NH3+HCl=NH4Cl
;
②上述c步实验中出现的现象说明
微粒(或分子)是不断运动的
微粒(或分子)是不断运动的
.
(5)近期发生的“三鹿”婴幼儿奶粉事件,敲响了食品安全的警钟.国家规定:每100g婴幼儿奶粉中蛋白质必须达12g-25g.为了测定奶粉中蛋白质的含量,可采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化为氨气,再用稀硫酸吸收氨气.
①蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收.丙氨酸(化学式为C
3H
7O
2N)就是一种氨基酸,丙氨酸中C、H、O、N各元素的质量比为
36:7:32:14
36:7:32:14
.
②蛋白质的代谢产物主要是尿素[CO(NH
2)
2],若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g.30g尿素中含氮元素
14
14
g.
③图2是某奶粉包装袋上的部分文字说明.现取该奶粉样品100g,用“盖尔达法”分解其中的蛋白质,产生氨气的质量为3.74g.

通过计算说明:该奶粉包装袋上所注蛋白质的含量是否真实(蛋白质含氮元素的质量分数为16%)?

 ×100%.进行解答;
×100%.进行解答; ×100%;
×100%; ×100%=46.7%;
×100%=46.7%; ×100%=14g;
×100%=14g;


 、
、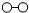 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
