
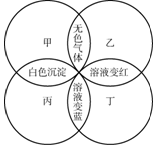
 甲、乙、丙、丁分别是紫色石蕊试液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象如图所示.
甲、乙、丙、丁分别是紫色石蕊试液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象如图所示.分析 根据石蕊遇酸变红色,遇碱变蓝色,稀硫酸和碳酸钠会生成二氧化碳气体,氢氧化钙和碳酸钠会生成白色的碳酸钙沉淀等知识进行分析.
解答 解:(1)石蕊遇酸变红色,遇碱变蓝色,稀硫酸和碳酸钠会生成二氧化碳气体,氢氧化钙和碳酸钠会生成白色的碳酸钙沉淀,乙和丁的实验现象是溶液变成红色,所以乙、丁是稀硫酸或紫色石蕊试液,甲、乙实验现象是生成无色气体,所以甲、乙是碳酸钠或稀硫酸,所以乙是稀硫酸,甲是碳酸钠溶液,丁是紫色石蕊试液,丙是澄清石灰水,所以丁是紫色石蕊试液,通常用途是:测试溶液的酸碱性;
(2)甲和丙的反应是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
故答案为:(1)紫色石蕊试液,测试溶液的酸碱性;
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
点评 解答本题关键是要知道石蕊溶液遇到酸变红色,遇到碱变蓝色,要熟悉方程式的写法和复分解反应的特点.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:初中化学 来源: 题型:选择题
| A. | 向纯碱溶液中滴加澄清石灰水:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH | |
| B. | 用NaOH溶液吸收CO2中含有少量的氯化氢气体:NaOH+HCl═NaCl+H2O | |
| C. | 用H2SO4洗去试管壁上附着的铜:Cu+H2SO4═CuSO4+H2O | |
| D. | 医疗上用氢氧化铝中和过多的胃酸:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 资料:A的溶解度 | |||||
| 温度/℃ | 20 | 30 | 40 | 50 | 60 |
| 溶解/g | 37.2 | 41.4 | 45.8 | 54.4 | 55 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧原子和氢气分子 | B. | 氧气分子和氢气分子 | ||
| C. | 氧原子和氢原子 | D. | 氢气和氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浓盐酸溶液和浓硫酸敞口放置一段时间,前者质量分数变小,后者质量分数变大 | |
| B. | 烧碱溶液和石灰水敞口放置一段时间,两者溶液质量均增大,pH值减小 | |
| C. | 稀盐酸中滴入硝酸银,氢氧化钠溶液中滴入氯化镁,直到都恰好反应.则前者溶液pH减小,后者溶液pH增大 | |
| D. | 烧碱固体和纯碱晶体暴露在空气中,前者会潮解导致质量增大,后者会风化导致质量变小 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
| 氯化钠(克) | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| 温度(℃) | 0 | 10 | 20 | 30 | … | 90 | |
| 纯碱(克) | 7.1 | 12.5 | 21.5 | 38.8 | … | 43.9 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 溶质 | H2SO4 | HCl | H2S | HCO3 |
| pH | 小→大 | |||
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com