
【题目】(8分)化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:(未做特别说明的“固体”,可能为纯净物或混合物)
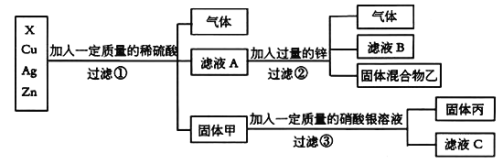
(1)四种金属的活动性由强到弱的顺序是 ;
(2)过滤操作中用到的玻璃仪器有烧杯、漏斗和 ,其作用是 ;
(3)滤液A中共含有 种溶质,固体丙中一定含有的金属是 ;
(4)写出③中反应的化学方程式 ;
(5)为了检验滤液C中的溶质成分:向其中加入稀盐酸,有白色沉淀产生,则滤液C中一定含有的阳离子 (填离子符号)。
【答案】(1)Zn > X > Cu > Ag (2)玻璃棒;引流
(3) 3;Ag
(4) Cu + 2AgNO3 === Cu(NO3)2 + 2Ag;(5)Ag+、Cu2+
【解析】
试题分析:根据金属活动性顺序的应用:位于氢前面的金属能将酸中的氢置换出来生成氢气,位于氢后面的金属不能与酸反应。由于铜和银位于氢的后面,故固体甲中一定含有铜和银;根据流程,向滤液A中加入过量的锌,若X不能与酸反应,那么加入过量的锌得到的固体中一定只含有锌,现得到的是固体混合物,说明X位于锌的后面且能与硫酸反应,即位于氢的前面,那么四种金属的活动性由强到弱的顺序是Zn > X > Cu > Ag;由于滤液A中加入锌生成了气体,故加入的稀硫酸是过量的,故滤液A中有硫酸、硫酸锌和硫酸X三种溶质;甲中含与铜和银,铜和硝酸银反应生成银和硝酸铜,故固体丙中一定含有银,可能含有铜;滤液C中中加入稀盐酸生成白色沉淀,说明滤液C中含有硝酸银,即含有银离子,同时还含有生成的硝酸铜,即:含有铜离子。


科目:初中化学 来源: 题型:
【题目】化学是一门以实验为基础的科学,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:
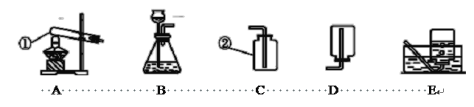
(1)写出指定仪器的名称: ② .
(2)实验室制取CO2的化学反应原理是(写化学方程式) .
(3)硫化氢(H2S)是一种无色,有臭鸡蛋气味的气体,它的密度比空气大,能溶于水,水溶液叫氢硫酸,硫化氢有剧毒。
①收集硫化氢气体时应选用 装置(填字母序号);
②实验室用硫化亚铁与稀盐酸反应制取硫化氢,同时生成氯化亚铁,写出制取硫化氢的化学方程式 ;
③从环保的角度考虑,制取硫化氢后应采取的措施是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)A-G是初中常见的物质。其中E为黑色固体。下图为这些物质的转化关系图,其中部分生成物和反应条件已省略。
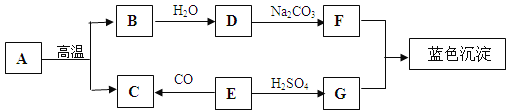
(1)写出下列物质的化学式:E ,G 。
(2)化学反应常伴有能量变化。B与水反应时会 (“吸收”或“放出”)热量。
(3)实验室不用A与稀硫酸反应来制取C,原因是 。
(4)写出D→F的化学方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)某铁合金5.8g,与足量的稀硫酸充分反应,得到0.2g的氢气。请计算:
(1)该合金中铁的质量是多少克?
(2)该合金是生铁还是钢?(已知:生铁的含碳量是2%—4%,钢的含碳量是0.03%—2%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法正确的是( )
A.含有氧元素的化合物一定是氧化物
B.含一种元素的物质一定是单质
C.由同种分子构成的物质一定是纯净物
D.混合物一定是由两种物质组成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你与他们一起完成以下探究活动:
【查阅资料】Na2CO3溶液呈碱性。
【对固体猜想】
猜想Ⅰ.全部是NaOH;
猜想Ⅱ.全部是Na2CO3。
猜想Ⅲ.是NaOH和Na2CO3的混合物。
【实验和推断】
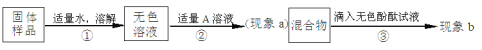
(1)若现象a为有气泡产生,则加入的A溶液是 ,说明氢氧化钠 (填“已经”或“没有”)变质。
(2)若A是CaCl2溶液。①现象a有白色沉淀产生,现象b无色酚酞不变红色,则猜想 成立。②猜想Ⅲ成立的实验现象是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)甲酸(HCOOH)是一种有机酸,它的酸性比碳酸强,比盐酸弱,有刺激性气味和较强的腐蚀性。蚂蚁、蚊虫叮咬时会分泌出甲酸,所以甲酸又俗称蚁酸。
(1)人被蚊虫叮咬后会痒痛,可以涂抹下列物质中的 (填字母)消除。
A.稀盐酸 B.食醋
C.肥皂水 D.食盐水
(2)白蚂蚁除了会蛀蚀木头外,它分泌的蚁酸还会腐蚀很多建筑材料,下列建筑材料不容易被蚁酸腐蚀的是 (填字母)。
A.钢筋 B.铜栏杆
C.大理石 D.铝合金窗户
(3)使用浓硫酸作催化剂,在加热的条件下,甲酸分解得到一种常见的有毒气体和另一种氧化物,其化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)阅读下面科普短文。
钠是一种活泼金属,其原子的结构示意图为![]() 。钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。钠还能与水反应,生成氢氧化钠和氢气。
。钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。钠还能与水反应,生成氢氧化钠和氢气。
目前,世界上多数采用电解熔融氯化钠的方法来制得金属钠。氯化钠的熔点为801℃,将氯化钠和氯化钙按质量比2:3混合共熔,可得到熔融温度约为580℃的共熔物,降低了电解所需的温度。电解时,正极放出氯气,负极产生的金属钠和金属钙同时浮在共熔物,从管道溢出。把熔融的金属混合物冷却到105~110℃,金属钙结晶析出,通过过滤可以分离出金属钠。
金属钠的应用非常广泛,可以用于制造过氧化钠(Na2O2)等化合物。还能用于生产更加昂贵的金属钾,以钠和氯化钾为原料,在高温条件下,生成钾和氯化钠,生成的钾能以蒸汽的形式分离出来。
依据文章内容,回答下列问题:
(1)在钠的原子结构中,与钠元素化学性质密切相关的是__________。
(2)钠具有的物理性质有__________。
(3)金属钠通常保存在石蜡油中,目的是隔绝__________。
(4)钠能与水反应,化学方程式为__________。
(5)写出用钠制取钾的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com