
| A. | KClO3中Cl的化合价为+6价 | B. | NH3中N的化合价为-3价 | ||
| C. | CO2中C的化合价为+2价 | D. | H2O、H2O2中O的化合价都是-2价 |
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:初中化学 来源: 题型:填空题
 如表是硝酸钾(KNO3)和氯化钾(KCl)在不同温度时的溶解度,请回答下列问题:
如表是硝酸钾(KNO3)和氯化钾(KCl)在不同温度时的溶解度,请回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、OH- | B. | Cl-、MnO4-、K+、Na+ | ||
| C. | SO42-、K+、Cl-、NO3- | D. | H+、NO3-、CO32-、Fe2+ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
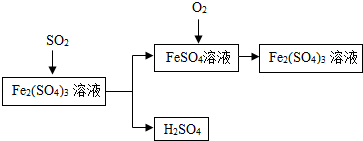 含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )
含硫煤燃烧会产生SO2造成大气污染,某工厂设计了如下工艺流程,防治污染的同时可以得到化工产品,下列叙述不正确的是( )| A. | 该流程中可得到化工产品H2SO4 | |
| B. | 该流程中化合价发生改变的元素为Fe和S | |
| C. | 流程中涉及到的反应之一为:Fe(SO4)3+SO2+2H2O=2FeSO4+2H2SO4 | |
| D. | 该工艺流程中Fe2(SO4)3溶液可以循环使用 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
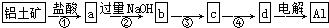
| A. | ①②中除加试剂外,还需要进行过滤操作 | |
| B. | a、b中铝元素的化合价相同 | |
| C. | ③中需要通入过量的氨气 | |
| D. | ④进行的操作是加热,而且d一定是氧化铝 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
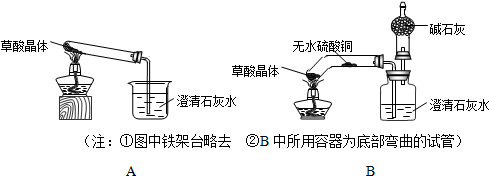
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com