
为测定锌铜合金中锌的含量,取该合金放入如图 14 盛有稀硫酸的锥形瓶中,发生反应: Zn+H2SO4=ZnSO4+H2↑ 。多次实验后,取平均值所得数据如下表:

|
反应前 |
充分反应后装置及反应剩余物质质量 |
|
|
装置和足量的稀硫酸质量 |
锌铜合金质量 |
|
|
342.10g |
16.00g |
357.70g |
若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量。
(2)该合金中锌的质量分数。
(1)0.4g (2)81.25%
【解析】有关化学方程式的就是按照有关化学方程式的简单计算的步骤:(1)设未知数(2)依据题意写方程式(3)写出相关量(4)列比例式求解(5)简单写出答案。该题中合金总共为16g ,但只有Zn和稀硫酸发生反应,通过反应前后质量的变化求出H2的质量,在通过H2的质量求出Zn的质量,进一步就出Zn的质量分数。
解:依题意可得
(1)氢气的质量=342.10g+16.00g-357.70g=0.4g
答:氢气的质量为0.4g
(2)解:设该合金中锌的质量为xg
Zn + H2SO4=ZnSO4+H2↑
65 2
x 0.4g
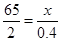
x=13g
答:该合金中锌的质量分数为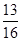
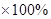 =81.25%
=81.25%


科目:初中化学 来源: 题型:
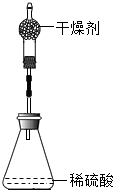 (2013?厦门)为测定锌铜合金中锌的含量,取该合金放入如图 盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4=ZnSO4+H2↑.多次实验后,取平均值所得数据如下表:
(2013?厦门)为测定锌铜合金中锌的含量,取该合金放入如图 盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4=ZnSO4+H2↑.多次实验后,取平均值所得数据如下表:| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌铜合金质量 | |
| 342.10g | 16.00g | 357.70g |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 稀H2SO4用量 | 剩余固体质量 |
| 第一次加入10.0克 | m |
| 第二次加入10.0克 | 5.4克 |
| 第三次加入10.0克 | 4.1克 |
| 第四次加入10.0克 | 2.8克 |
| 第五次加入10.0克 | 1.6克 |
| 第六次加入10.0克 | 1.6克 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 稀H2SO4用量 | 剩余固体质量 |
| 第一次加入10.0克 | m |
| 第二次加入10.0克 | 5.4克 |
| 第三次加入10.0克 | 4.1克 |
| 第四次加入10.0克 | 2.8克 |
| 第五次加入10.0克 | 1.6克 |
| 第六次加入10.0克 | 1.6克 |
查看答案和解析>>
科目:初中化学 来源: 题型:
某化学兴趣小组同学为测定锌铜合金中锌的质量分数,称取8.0克合金样品,将60.0克稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称量.得到实验数据如下.
| 稀H2SO4用量 | 剩余固体质量 |
| 第一次加入10.0克 | m |
| 第二次加入10.0克 | 5.4克 |
| 第三次加入10.0克 | 4.1克 |
| 第四次加入10.0克 | 2.8克 |
| 第五次加入10.0克 | 1.6克 |
| 第六次加入10.0克 | 1.6克 |
(1)表格中,m= 克.
(2)该锌铜合金锌的质量分数为 .
(3)计算所用稀H2SO4中溶质的质量分数.(请写出计算过程,结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源:2012年四川省巴中市中考化学试卷(解析版) 题型:解答题
| 稀H2SO4用量 | 剩余固体质量 |
| 第一次加入10.0克 | m |
| 第二次加入10.0克 | 5.4克 |
| 第三次加入10.0克 | 4.1克 |
| 第四次加入10.0克 | 2.8克 |
| 第五次加入10.0克 | 1.6克 |
| 第六次加入10.0克 | 1.6克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com