
| 实验操作 | 预期现象和必要结论 |
| 步骤1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤 | / |
| 步骤2:取少量步骤1所得的滤液于试管中,向其中加入足量的稀盐酸,振荡,观察现象.. | 有气泡生成 |
| 步骤3:向步骤2反应后溶液中滴入少量的BaCl2溶液,观察现. | 若有白色沉淀生成,说明样品中有ZnSO4; 若无明显现象,说明样品中没有ZnSO4. |
分析 (1)①根据主要配料为生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl),用水和粘土调制成糊状分析发生的反应有:水和生石灰反应生成氢氧化钙;纯碱和氢氧化钙反应,生成碳酸钙和氢氧化钠;
②由于CaO少量,Na2CO3过量,故反应后Na2CO3剩余,滤液中有NaOH、Na2CO3、NaCl,由此分析滤液中含有的阴离子.
(2)步骤1所得的溶液中含有C1-、OH-、CO32-,在检验是否有SO42-,CO32-的存在会干扰,所以先加入足量的稀盐酸排除CO32-的干扰,然后再加入BaCl2溶液检验SO42-.由此分析解答.
解答 解:
(1)①根据原料可知发生的反应有:水和生石灰反应生成氢氧化钙;纯碱和氢氧化钙反应,生成碳酸钙和氢氧化钠;
故答案为:CaO+H2O=Ca(OH)2;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
②由于CaO少量,Na2CO3过量,故反应后Na2CO3剩余,滤液中有NaOH、Na2CO3、NaCl,滤液中含有的阴离子有C1-、OH-、CO32-
故答案为:滤液中除含有C1-、OH-外,还含有的阴离子是CO32-;
(2)步骤1所得的溶液中含有C1-、OH-、CO32-,在检验是否有SO42-,CO32-的存在会干扰,所以先加入足量的稀盐酸排除CO32-的干扰,然后再加入BaCl2溶液检验SO42-.若有白色沉淀生成,说明样品中有ZnSO4;若无明显现象,说明样品中没有ZnSO4.
答案:
(1)①CaO+H2O=Ca(OH)2;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;②CO32-;
(2)
| 实验操作 | 预期现象和必要结论 |
| 步骤1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤 | / |
| 步骤2:取少量步骤1所得的滤液于试管中,向其中加入足量的稀盐酸,振荡,观察现象. | 有气泡生成 |
| 步骤3:向步骤2反应后溶液中滴入少量的BaCl2溶液,观察现象. | 若有白色沉淀生成,说明样品中有ZnSO4; 若无明显现象,说明样品中没有ZnSO4. |
点评 本题属于信息题的考查,考查了常见酸碱盐的化学性质及物质的检验等,难度不大,注意利用相关的知识进行分析.


科目:初中化学 来源: 题型:选择题
| A. | 气体更易被压缩--构成气体的分子具有弹性 | |
| B. | 液氧为淡蓝色--氧气分子是蓝色的 | |
| C. | 湿衣服变干--水分子在不断地运动 | |
| D. | 碘受热升华--碘分子变大了 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 温度/℃ | 20 | 40 | 60 | 80 | |
| 溶解度/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
| KNO3 | 31.6 | 63.9 | 110 | 169 | |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
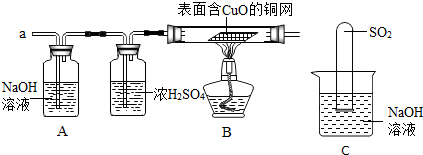
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
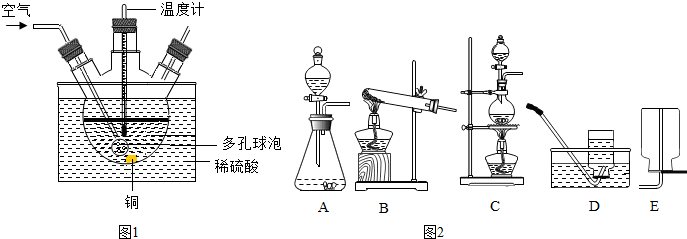
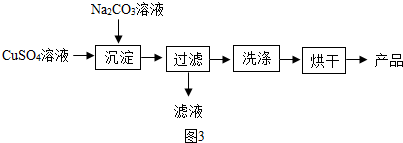
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 该反应是置换反应 | B. | 该反应生成两种物质 | ||
| C. | 在化学反应前后分子个数一定不变 | D. | 化学反应前后原子种类不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
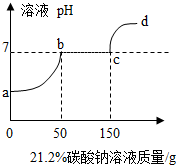 往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com