
【题目】某金属冶炼厂在生产过程中产生了一定量的含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并获得硫酸亚铁晶体。其设计方案如图所示。
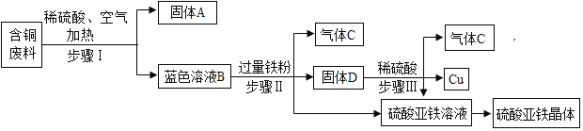
查阅资料得知:在通入空气并加热的条件下,铜可与稀硫酸反应转化为硫酸铜,反应的化 学方程式:2Cu + 2H2SO4 + O2![]() 2CuSO4+2H2O
2CuSO4+2H2O
(1)步骤Ⅰ中分离得到固体 A 和蓝色溶液 B 的操作名称是_________,所需玻璃仪器_____________。
(2)步骤 II 中加过量铁粉的目的______________。
(3)写出步骤Ⅲ中发生反应的化学方程式___________。
(4)硫酸亚铁溶液得到硫酸亚铁晶体通常要经过蒸发浓缩、___________、洗涤、干燥等步骤。
(5)铜制品在空气中会发生锈蚀[铜锈的主要成分 Cu2(OH)2CO3],根据铜锈的主要成分,可以判断出铜生锈除了需要氧气,还需要空气中的___________(填化学式)。
【答案】过滤 烧杯、漏斗、玻璃棒 使CuSO4、H2SO4完全反应 Fe + H2SO4 =FeSO4 + H2↑ 冷却结晶 H2O、CO2
【解析】
由题意可知,废料中的铜与氧气反应生成氧化铜,氧化铜与硫酸反应生成硫酸铜和水,所以蓝色溶液中的溶质中含有硫酸铜,根据蓝色溶液中加入铁有气体产生,说明蓝色溶液中含有过量的硫酸;加入铁粉是利用铁与硫酸铜反应生成铜和硫酸亚铁,将铜置换出来,得到硫酸亚铁,铁与硫酸反应生成硫酸亚铁和氢气,也是获得硫酸亚铁,所以加入过量的铁粉,过量的目的是使CuSO4、H2SO4完全反应;固体C中可能含有铁,所以先用硫酸清洗把铁除掉,再用水冲洗,最后进行干燥,即可得到铜。
(1)步骤I中分离得到固体A和蓝色溶液B的操作名称是过滤;所需玻璃仪器烧杯、漏斗、玻璃棒;
(2)步骤 II 中加过量铁粉的目的使CuSO4、H2SO4完全反应。
(3)步骤Ⅲ中发生反应是铁与硫酸反应生成硫酸亚铁和氢气,反应的化学方程式Fe + H2SO4 =FeSO4 + H2↑;
(4)硫酸亚铁溶液得到硫酸亚铁晶体通常要经过蒸发浓缩、冷却结晶、洗涤、干燥等步骤。
(5)铜制品在空气中会发生锈蚀[铜锈的主要成分Cu2(OH)2CO3],根据铜锈的主要成分,可以判断出铜生锈除了需要氧气,根据质量守恒定律可知,Cu2(OH)2CO3中的氢元素由空气中的水蒸气提供,碳元素由二氧化碳提供。还需要空气中的H2O、CO2。


科目:初中化学 来源: 题型:
【题目】如下图:若关闭Ⅱ阀打开Ⅰ阀,紫色小花(用石蕊溶液染成)变红;若关闭Ⅰ阀打开Ⅱ阀,紫色小花不变红。则甲瓶中所盛的试剂可能是 (提示:浓硫酸具有吸水性,NaOH溶液可以吸收CO2)
①浓H2SO4 ②浓NaOH溶液 ③饱和NaCl溶
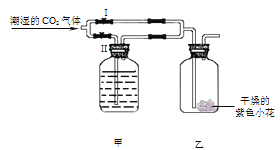
A. 只有①B. 只有②C. ①②D. ①②③
查看答案和解析>>
科目:初中化学 来源: 题型:
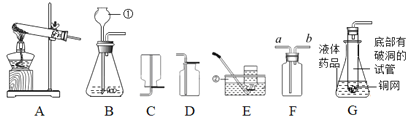
【题目】实验室常用下列装置来制取氧气:


(1)写出图中有标号仪器的名称:a_____;b_____;
(2)小明若用B装置来制取氧气,长颈漏斗添加药品的名称是_____,与B装置做比较,C装置的优点是_____;
(3)小华选用A装置制取氧气时,所需的药品是_____;棉花团的作用_____;去掉棉花团,还可以选择氯酸钾制取氧气,写出反应的文字表达式_____,你认为以上三种制取氧气的方法,哪一种更好?_____ (填“小明”或“小华”),理由是_____;
(4)如果用D装置收集时,如何证明该瓶内的氧气已满:_____;若要用G装置收集较纯净的氧气,可先在G装置中装满水,应从_____口进入(填“c”或“d”);
(5)实验室常用氯化铵固体与碱石灰固体共热来制取氨气。常温下氨气是一种无色有刺激性气味的气体,密度比空气小,极易溶于水。若制取并收集氨气,应该从上图A-E中选择的发生装置和收集装置分别是_____,若改用G装置收集氨气,则应从 _____ 口进(填“c”或“d”);
(6)某学生学习了双氧水制氧气的实验后,想起自己家里也有一瓶消毒用双氧水,由于标签已部分受损无法判断其是否变质,所以他取了少量液体放入试管内然后又放入少量的二氧化锰,二氧化锰的作用是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为12.0 g,剩余固体中钙元素质量分数为50.0%。下列判断正确的是
A.生成3.0 g CO2气体B.剩余CaCO3的质量为3. 3 g
C.生成了8.4 g CaOD.原来CaCO3的质量为16.3 g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向 100g 水中不断加入固体 A 或改变温度,得到相应的溶液①~⑤。下列说法正确的是( )
![]()

A.②中 A 的质量分数最大B.③⑤中 A 的质量分数相等
C.②④⑤的溶液为饱和溶液D.①③④⑤中没有固体存在
查看答案和解析>>
科目:初中化学 来源: 题型:
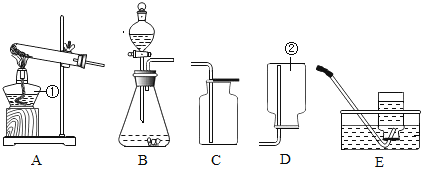
【题目】下面是实验室常用仪器组成的装置,请回答下列问题:
(1)指出标号仪器的名称:①_____②_____;
(2)用A装置制取氧气的化学方程式为_____,基本反应类型是_____;
(3)实验室制取二氧化碳的 反应方程式是_____;若用F装置收集CO2,CO2从_____(填“a”或“b”)导管口通入;
(4)G图是某同学利用底部有破洞的试管设计的制取二氧化碳的发生装置,若将铜网改成铁网,产生的后果之一是收集到的气体不纯,原因是(用化学方程式表示)_____。
(5)已知氨气是一种极易溶于水的气体,密度比空气小,实验室可用氧化钙固体与浓氨水在常温下混合制成氨气(NH3),则应选用的气体发生装置是_____(填装置序号),收集装置是_____(填装置序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图所示装置回答下列有关问题:
![]() 写出如图中标有序号的仪器名称:① ______;② ______。
写出如图中标有序号的仪器名称:① ______;② ______。
![]() 实验室制取气体时,组装好仪器后,应先______,再添加药品。
实验室制取气体时,组装好仪器后,应先______,再添加药品。
![]() 实验室用高锰酸钾制取氧气,选择的发生装置和收集装置是______
实验室用高锰酸钾制取氧气,选择的发生装置和收集装置是______![]() 填字母
填字母![]() ,其反应的化学方程式为______。
,其反应的化学方程式为______。
![]() 实验室用制取二氧化碳时,应选用的药品是______,用C装置收集二氧化碳时如何检验气体是否收集满______。
实验室用制取二氧化碳时,应选用的药品是______,用C装置收集二氧化碳时如何检验气体是否收集满______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类文明的发展和社会的进步同金属材料关系十分密切。
(一)铁的应用及防护
(1)生活中常用铁锅烹饪,主要利用铁的_____(填字母)。
a 导电性 b 导热性 c 耐腐蚀
(2)“发蓝“处理是在铁表面形成致密氧化膜,以防止其腐蚀。“发蓝”的原理是:36Fe + 4NaNO2 + 9NaNO3 + 26H2O=12X + 13NaOH + 13NH3↑,X的化学式为_____
(3)患贫血症的人体内需要补铁 ____(填字母)。
a 分子 b 原子 c 元素
(4)如图为某兴趣小组探究铁生锈的三个实验,最先观察到铁锈的是____(选填序号)。

(5)铁生锈的主要过程为:
![]()
写出Fe(OH)2→Fe(OH)3反应的化学方程式______。
(二)铁的冶炼和探究
取20.0g Fe2O3粉末,小组同学用下图装置模拟炼铁,并测定反应后固体成分。
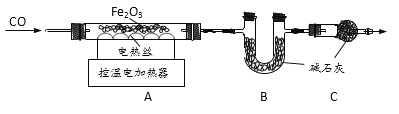
资料:碱石灰可吸收H2O和CO2。
(1)连接装置,先____,再装入药品。
(2)实验时先通入CO,目的是___。
(3)该实验装置有一个明显缺陷,你认为是___。
(4)控制A中温度在700℃至固体全部变黑,继续通CO至冷却。
①通过测定装置B中固体的质量变化,可准确求得装置A中剩余固体质量。装置C的作用是____。
②现直接测得装置A中剩余固体质量为17.2g。则装置B中固体应增重___g。
(5)经分析A中剩余固体17.2g为Fe和FexOy的混合物,向其中加入足量的稀H2SO4,充分反应,得H2 质量为0.1g。(FexOy和稀H2SO4反应,但无气体产生)
①固体中Fe质量为______g。 ②FexOy的化学式为____。
(三)成分探究
(查阅资料)用CO还原Fe2O3炼铁的过程大致分为三个阶段:
阶段1:3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO![]() 3FeO+CO2
3FeO+CO2
阶段3:FeO+CO ![]() Fe+CO2
Fe+CO2
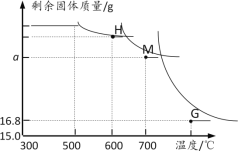
另取一定量Fe2O3进行上述实验,加热时固体质量随温度变化的曲线如图所示.回答下列问题:
(1)温度控制在300℃—500℃范围时,固体质量没有发生变化,原因是____。
(2)图中H点对应的固体成分的化学式是____
(3)图中M点对应a的数值=___
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组为探究生铁中铁的含量(生铁中只考虑铁,碳),设计有关方案,取0.58克生铁放于试管中,实验中将注射器内76毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为300毫升。已知实验条件下氢气的密度为0.09g/L。
(1)计算生铁中铁的质量分数?_____(写出计算过程,氢气质量保留两位小数,结果保留到0.1℅)
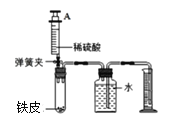
(2)上述方法测得的生铁中铁的质量分数偏小,可能的原因是_____。
A 没等装置冷却就读数 B 生铁中含有少量锌
C 试管中有氢气没有排出 D 将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com