
(6分)称取NaCl和BaCl2的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示.试回答下列问题: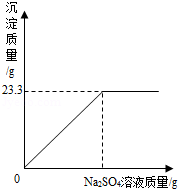
(1)完全反应后生成BaSO4沉淀 g.
(2)恰好完全反应时消耗Na2SO4溶液的质量是多少克?
(3)恰好完全反应时所得溶液中溶质的质量分数是多少?
(1)23.3; (2) 142g (3) 9.3%
解析试题分析:根据图示可知生成沉淀的质量;硫酸钠与氯化钡反应会沉淀硫酸钡沉淀,根据沉淀的质量,利用化学方程式硫酸钡与硫酸钠的质量比可求出硫酸钠的质量。
设BaCl2的质量为x,反应生成的NaCl的质量为y;恰好完全反应时消耗Na2SO4的质量为z
BaCl2+Na2SO4═BaSO4↓+2NaCl
208 142 233 117
x z 23.3g y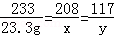 =
=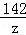
x=20.8g
y=11.7g
z=14.2g
(2)恰好完全反应时消耗Na2SO4溶液的质量为:14.2g÷10%=142g
(3)恰好完全反应时,溶液中NaCl的质量为:11.7g+(32.5g﹣20.8g)=23.4g
恰好完全反应时所得NaCl 溶液溶质的质量分数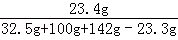 ×100%=9.3%
×100%=9.3%
答:恰好完全反应时所得NaCl 溶液溶质的质量分数为9.3%
考点:利用化学方程式的计算、有关溶质质量分数的计算


科目:初中化学 来源: 题型:填空题
有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合如图所示的质量关系.(不计损耗)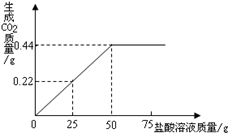
(1)样品完全反应后,共放出二氧化碳气体的物质的量为 mol。
(2)计算样品中氯化钠的质量分数。(根据化学方程式列式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)工业上通常用黄铁矿(主要成分FeS2)为原料生产硫酸,先将黄铁矿粉碎,然后按照以下流程制备硫酸: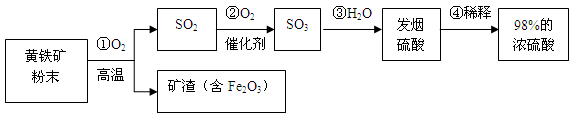
⑴ 先将黄铁矿石粉碎的目的是 。
⑵ 写出稀释浓硫酸的具体操作步骤 。
⑶ 将10g98%的浓硫酸稀释成9.8%的稀硫酸,需要加水 g。
⑷ 取20g矿渣样品(含Fe2O3),向其中加入300g溶质质量分数为9.8%的稀硫酸(已知矿渣中的Fe2O3与稀硫酸恰好完全反应得到Fe2(SO4)3溶液),试通过化学方程式计算该矿渣样品中Fe2O3的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)某同学做了如下实验: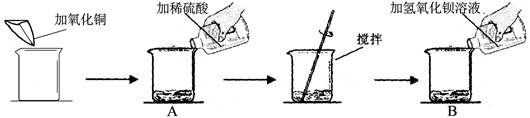
实验数据及部分实验现象如下表:
| | 第一次[来源:学.科.网Z.X.X.K] | 第二次 |
| 加氧化铜的质量(g) | m | m |
| 加稀硫酸的质量(g) | 50 | 100 |
| 加氢氧化钡溶液的质量(g) | 100 | 100 |
| B中主要现象 | 淡蓝色沉淀 | ? |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(12分)下图是某同学完成《实验活动5 一定质量分数的氯化钠溶液的配制》中“配制
50 g质量分数为6%的氯化钠溶液”的全过程。
(1)图中的错误有:
① ;
② 。
(2)若所配制的盐水中NaCl 的质量分数小于6%,则可能造成误差的原因有(至少举
出两点)。
① ;
② 。
(3)由浓溶液配制稀溶液时,计算的依据是 。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是 。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶并贴上标签。
(4)取某稀硫酸样品10g,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌。溶液pH的变化如图所示。试回答: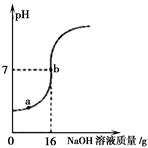
①a点溶液中含有的离子有 。
②当pH=7时,消耗NaOH溶液中NaOH的质量为 g。
③计算稀硫酸的溶质质量分数。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(10分)市售珍珠粉的价格相差很大,但其外观、手感都没有明显差异,优质珍珠粉和廉价珍珠粉的成分有何不同呢?实验小组同学展开探究。
【查找资料】
①优质珍珠粉直接由贝科动物体内珍珠加工而成,含有一定量的氨基酸、碳酸钙等。
②廉价珍珠粉由“贝壳粉”加工而成,贝壳加工过程中会用到氢氧化钠,贝壳的主要成分是碳酸钙。
③珍珠粉中除碳酸钙外,其它成分均不能与盐酸反应生成二氧化碳。
④氨基酸大部分能溶解于水,遇到浓硝酸并加热会呈现黄色或黑色。
⑤碳酸钙与浓硝酸能发生反应,生成二氧化碳。
⑥氯化钙溶液呈中性。
【提出猜想】优质珍珠粉和廉价珍珠粉的区别可能在于:
①廉价珍珠粉含有 ;
②廉价珍珠粉不含氨基酸;
③碳酸钙含量不同。
【实验探究】
| 实 验 内 容 | 现 象 | 结 论 |
| (1)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,静置一段时间后,滴加 。 | 廉价珍珠粉的上层清液变红,优质珍珠粉的溶液没有变色 | 猜想①成立 |
| (2)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,过滤, ,加热。 | 优质珍珠粉的溶液有黄色出现,局部变黑,廉价珍珠粉的溶液没有明显现象 | 猜想 成立 |
| | 优质珍珠粉 | 廉价珍珠粉 |
| 珍珠粉的质量 | 100g | 100g |
| 加入盐酸的质量 | 460.0g | 500g |
| 烧杯中最终物质的总质量 | 520.0g | 558.2g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(8分)某同学称取a g铜锌合金,加入足量稀硫酸,充分反应后测得生成气体的质量为b g,剩余固体经过滤、洗涤、干燥后,称得质量为c g.请问:
(1)a g铜锌合金中锌的质量为 g(用代数式表示).
(2)根据化学反应方程式,推导出a、b、c三者之间的等量关系(写出详细的计算推导过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com