【答案】
分析:(1)以过氧化氢溶液为原料制备氧气生成水和氧气;浓硫酸具有吸水性;用排气法可以收集干燥的气体;气体的发生装置的出口有两个时,要先设法堵住一个,再进行检查其气密性的好坏;
(2)①浓硫酸的作用是干燥氢气;
②氢气还原氧化铜生成铜和水;
③B
2装置增加的质量是氢气还原氧化铜生成的水的质量,则E装置中固体减少的质量是氧化铜中氧元素的质量,依据反应前后元素的质量不变,即生成的水中氧元素的质量;
④根据锌与硫酸反应,且不生成新的杂质;充分反应后过滤,将滤液蒸发、冷却、结晶,即可得到较纯净的硫酸锌晶体进行解答.
解答:解:
(1)①用A装置可以制取氧气,再通过B装置除去氧气中的水蒸气,最后用D装置收集氧气;
故答案为:A→B→D;
②过氧化氢在催化剂的催化作用下,能生成水和氧气,反应的化学方程式为:2H
2O
2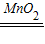
2H
2O+O
2↑;
故答案为:2H
2O
2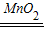
2H
2O+O
2↑;
③检验A装置气密性的方法是:先从长颈漏斗中注入水,当水浸没其下端管口时,用弹簧夹夹住导气管上连接的胶皮管,然后再加入少量的水,若停止加水后,长颈漏斗中的水面不再下降,则说明此装置气密性良好;
故答案为:先从长颈漏斗中注入水,当水浸没其下端管口时,用弹簧夹夹住导气管上连接的胶皮管,然后再加入少量的水,若停止加水后,长颈漏斗中的水面不再下降,则说明此装置气密性良好;
(2)①探究氢气是否具有还原性,可将氢气通过E装置;若E中固体粉末由黑色变为红色,B
2质量增加,说明反应生成了水,则证明氢气具有还原性;因此,必须排除开始的氢气中的水蒸气,防止干扰;所以利用B
1的除掉氢气中的水蒸气;
故答案为:除去氢气中的水蒸气或干燥氢气;
②若E中固体粉末由黑色变为红色,说明黑色的氧化铜发生反应生成了铜;B
2质量增加,说明反应生成了水;
故答案为:H
2+CuO
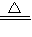
Cu+H
2O;
③B
2装置增加的质量是氢气还原氧化铜生成的水的质量,则E装置中固体减少的质量是氧化铜中氧元素的质量,依据反应前后元素的质量不变,即生成的水中氧元素的质量,所以E装置中固体质量减少是:0.9g×
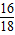
×100%=0.8g;
故答案为:0.8g;
④BaCl
2溶液不仅能和硫酸反应,而且能和硫酸锌反应,故不能使用;
根据锌与硫酸反应,且不生成新的杂质;硫酸完毕,锌粉剩余,充分反应后过滤,然后将滤液蒸发、冷却、结晶,即可得到较纯净的硫酸锌晶体;
NaOH溶液不仅能和硫酸反应,生成新的杂质硫酸钠,而且能和硫酸锌反应,故不能使用;
故答案为:向废液中加入足量的锌粉,充分反应后过滤,将滤液蒸发、冷却、结晶,即可得到较纯净的硫酸锌晶体.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

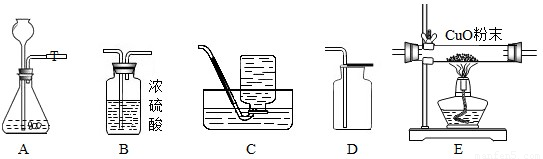
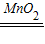 2H2O+O2↑;
2H2O+O2↑;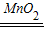 2H2O+O2↑;
2H2O+O2↑;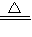 Cu+H2O;
Cu+H2O;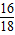 ×100%=0.8g;
×100%=0.8g;

 阅读快车系列答案
阅读快车系列答案




 2H2O+O2↑。用此法制氧气和收集氧气,应选用的装置单元组合为________________________;二氧化锰应放在(填仪器名称)____________________________中;该组合能否控制反应?为什么?____________________。
2H2O+O2↑。用此法制氧气和收集氧气,应选用的装置单元组合为________________________;二氧化锰应放在(填仪器名称)____________________________中;该组合能否控制反应?为什么?____________________。