
| 稀盐酸的用量 | 第一次加5克 | 第一次加5克 | 第一次加5克 | 第一次加5克 |
| 剩余固体的质量 | 1.3 | 0.6 | 0.2 | 0.2 |
| 2g-0.2g |
| 2g |
| 100 |
| 0.7g |
| 73 |
| x |
| 0.511g |
| 5g |
| ||
| 100 |
| 100g×90% |
| 56 |
| x |


科目:初中化学 来源: 题型:
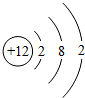 ,镁原子在化学反应中容易
,镁原子在化学反应中容易查看答案和解析>>
科目:初中化学 来源: 题型:
| A、单质 | B、化合物 |
| C、混合物 | D、无法确定类别 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、量筒、烧杯、漏斗、玻璃棒 |
| B、玻璃棒、托盘天平、药匙、烧杯 |
| C、玻璃棒、托盘天平、量筒、烧杯 |
| D、玻璃棒、滴管、量筒、烧杯 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、铯137原子的核外电子数为82 |
| B、铯137的相对原子质量为137g |
| C、铯137原子的核电荷数为55 |
| D、铯137原子的中子数与核外电子数之差为0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
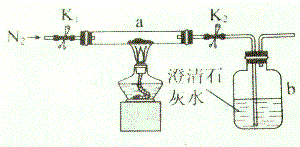 取m1g某铁的化合物粉末(由两种元素组成)进行如下实验.将该粉末和足量碳粉(C)充分混合,平铺在反应管a中,b瓶中盛有新制的澄清石灰水.按图10所示连接仪器(铁架台等固定装置未画出)并检查气密性.
取m1g某铁的化合物粉末(由两种元素组成)进行如下实验.将该粉末和足量碳粉(C)充分混合,平铺在反应管a中,b瓶中盛有新制的澄清石灰水.按图10所示连接仪器(铁架台等固定装置未画出)并检查气密性.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com