
| 甲 | 乙 | 丙 | |
| 取用金属混合物的质量/g | 10 | 10 | 20 |
| 取用稀硫酸的质量/g | 100 | 120 | 100 |
| 反应后过滤,得干燥固体的质量/g | 4.4 | 4.4 | 14.4 |
分析 根据铁和铜与酸的反应进行分析,铁能与稀硫酸反应生成氢气,铜不与稀硫酸反应生成氢气,取10g混合物,与100g硫酸和120g硫酸反应都剩余4.4g固体,则可以判断10g混合物中含有铜的质量为4.4g,含铁的质量为5.6g,取20g混合物,与100g硫酸反应剩余14.4g固体,则说明与5.6g铁反应需要硫酸的质量为100g,然后根据反应的化学方程式求硫酸亚铁和稀硫酸的质量.
解答 解:(1)比较甲乙两组数据可以知道,取10g混合物,分别与100g硫酸和120g硫酸反应都剩余4.4g固体,说明混合物中的铁全部参加反应,可以判断10g混合物中含有铜的质量为4.4g,所以混合物中含铁的质量为5.6g;
(2)分析丙中的数据可以知道,取20g混合物,与100g硫酸反应剩余14.4g固体,结合甲组的数据可以知道与5.6g铁反应需要硫酸的质量为100g,所以甲同学取的金属混合物与硫酸恰好完全反应,
设生成硫酸亚铁的质量为x,与5.6g铁反应需要硫酸的质量为y,生成氢气的质量为z.
Fe+H2SO4═FeSO4+H2↑
56 98 152 2
5.6g y x z
则$\frac{56}{5.6g}=\frac{98}{y}=\frac{152}{x}$=$\frac{2}{z}$,解得:x=15.2g,y=9.8g,z=0.2g;
所用稀硫酸中溶质的质量分数为:$\frac{9.8g}{100g}$×100%=9.8%.
(3)制得硫酸亚铁的质量为15.2g,
故甲同学所得溶液中溶质的质量分数$\frac{15.2g}{5.6g+100g-0.2g}$×100%≈14.4%
故答案为:
(1)5.6g.(2)9.8%.(3)14.4%.
点评 本题主要考查学生对金属的化学性质的认识,以及运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:初中化学 来源: 题型:选择题
| A. | +7、-3、+5、+5 | B. | +8、+1、+1、+5 | C. | +8、-4、+6、+5 | D. | +7、-3、+5、+6 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
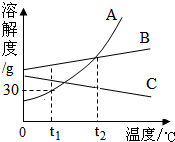 A、B、C三种不含结晶水的固体物质的溶解度曲线如图,回答有关问题.
A、B、C三种不含结晶水的固体物质的溶解度曲线如图,回答有关问题.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 回答下列问题;
回答下列问题;查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com