
| A. | 10g碳酸钙和5.6g氧化钙 | B. | 4.2g碳酸镁和2g硝酸银 | ||
| C. | 10g碳酸钙和10g碳酸钠 | D. | 1.8g铝粉和1.8g铁粉 |
分析 因为加入的盐酸质量相等,所以需要判断两端加入一定量物质后增加质量是否相等,增加质量相等时天平能仍然保持平衡,不相等时天平发生偏转.可根据化学方程式,借助关系式和差量法进行分析比较.
解答 解:A、50g14.6%的稀盐酸完全反应消耗碳酸钙的质量分别为x
CaCO3~2HCl
100 73
x 7.3g
$\frac{100}{x}$=$\frac{73}{7.3g}$
x=10g,
碳酸钙过量,生成的气体由10g碳酸钙生成,
则生成的CO2的质量为:$\frac{10g×44}{100}$=4.4g,烧杯质量增加了10-4.4=5.6g,
而氧化钙和盐酸反应不放出气体,所以增加5.6g,所以天平平衡,故A正确;
B、硝酸银与盐酸反应不产生气体,因此增加的质量即为加入的硝酸银溶液质量2g;
而MgCO3与盐酸反应放出气体二氧化碳,
MgCO3 ~CO2
84 44
4.2 m
$\frac{84}{4.2g}$=$\frac{44}{m}$
m=2.2g
所以加碳酸镁后烧杯质量增加质量为4.2-2.2=2g,所以天平仍然平衡,故B正确;
C、CaCO3+2HCl=CaCl2+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑
100 73 106 73
由化学方程式可知,碳酸钠、碳酸钙过量,所以依据盐酸可以求出生成的二氧化碳质量相等,所以反应后烧杯中中增加质量相等,天平平衡,故C正确;
D、50g14.6%的稀盐酸中HCl质量=50g×14.6%=7.3g
50g14.6%的稀盐酸完全反应消耗金属铝和铁的质量分别为:
2Al~6HCl
54 219
m(Al) 7.3g
$\frac{54}{m(Al)}$=$\frac{219}{7.3g}$
m(Al)=1.8g
Fe~2HCl
56 73
m(Fe)7.3g
$\frac{56}{m(Fe)}$=$\frac{73}{7.3g}$
m(Fe)=5.6g
则金属铝未完全反应,铁不足,所以消耗盐酸量不同,放出氢气质量不相等;天平失去平衡,故D错误.
故选:ABC.
点评 加入物质充分反应后,天平一端增加的质量=加入固体质量-放出气体的质量,只有加入物质与放出气体质量均相等时,天平才能保持平衡.由于运算量比较大,所以对于有关化学方程式的计算是否熟练是解题的关键.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向煤炭中加入石灰石或生石灰作固硫剂,减少二氧化碳的排放 | |
| B. | 控制PM2.5的排放以减少雾霾天气 | |
| C. | 将盗版光盘碾压粉碎后回收再利用 | |
| D. | 提倡节日大量燃放烟花爆竹,增加喜庆气氛 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 现有一瓶葡萄糖(C6H12O6)溶液,部分标签如图所示.
现有一瓶葡萄糖(C6H12O6)溶液,部分标签如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
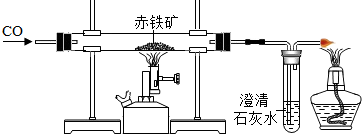 善于提出问题,解决问题是学好科学的重要方法.某研究性学习小组的同学在学习铁及其化合物知识时进行了系列研究:
善于提出问题,解决问题是学好科学的重要方法.某研究性学习小组的同学在学习铁及其化合物知识时进行了系列研究:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com