

分析 (1)根据食盐是由Na+、Cl-构成的进行分析;
(2)①根据氢氧化钠在水中会解离出钠离子、氯离子进行分析;
②根据a点溶液的pH值大于7进行分析;
(3)根据氢氧化钠和碳酸钠在溶液中都显碱性,硫酸铜显蓝色,碳酸钠和氯化钙会生成碳酸钙沉淀进行分析;
(4)根据NaOH溶液能与氯化镁溶液反应生成氢氧化镁白色沉淀,BaCl2溶液能与Na2SO4溶液反应生成硫酸钡白色沉淀,碳酸钠溶液能与氯化钙溶液反应生成碳酸钙白色沉淀,碳酸钠溶液能与过量的氯化钡溶液反应生成碳酸钡白色沉淀,盐酸能与过量的氢氧化钠、碳酸钠溶液反应进行分析;
(5)根据化学方程式和题中生成的二氧化碳气体进行计算.
解答 解:(1)汗水中含有大量的食盐,食盐是由Na+、Cl-构成的;
(2)①氢氧化钠在水中会解离出钠离子、氯离子,所以甲处应填入的粒子符号是OH-;
②a点溶液的pH值大于7,所以a点时溶液中的溶质有NaCl、NaOH;
(3)氢氧化钠和碳酸钠在溶液中都显碱性,硫酸铜显蓝色,碳酸钠和氯化钙会生成碳酸钙沉淀,
取适量样品于试管中,滴加酚酞溶液,溶液变成红色,溶液中含有碳酸钠、氢氧化钠中的一种或两种,再向试管中逐滴加入过量氯化钙溶液(氯化钙溶液呈中性),有沉淀产生,充分反应后溶液仍为红色,所以样品中一定含有NaOH、Na2CO3,一定不含硫酸铜,可能含有NaCl;
(4)I、碳酸钠中的碳酸根离子会与钡离子和钙离子反应生成碳酸钡和碳酸钙沉淀,因此加入Na2CO3溶液的目的是除去溶液中的钙、钡离子;所以操作②和操作③的顺序不能颠倒;
II、除杂时加入的碳酸钠、氢氧化钠是过量的,对于氯化钠来说,也是杂质,所以加入盐酸的目的是:除去过量的NaOH 和Na2CO3;
(5)设20g纯碱样品中Na2CO3的质量为x
Na2CO 3+2HCl═2NaCl+H2O+CO2↑
106 44
x 6.6g
$\frac{106}{x}$=$\frac{44}{6.6g}$
x=15.9g
该纯碱样品中碳酸钠的质量分数为:$\frac{15.9g}{20g}$×100%=79.5%.
故答案为:(1)Na+、Cl-;
(2)①OH-;
②NaCl、NaOH;
(3)NaOH、Na2CO3,NaCl;
(4)(Ⅰ) 颠倒后无法除去过量的BaCl2;
(Ⅱ) 除去过量的NaOH 和Na2CO3;
(5)该纯碱样品中碳酸钠的质量分数为:$\frac{15.9g}{20g}$×100%=79.5%.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.


科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
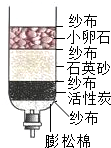 水是生命之源,我们应该了解水、爱护水.
水是生命之源,我们应该了解水、爱护水.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  常温下,稀释KOH溶液 | |
| B. |  甲烷和过量的氧气在密闭容器中完全反应 | |
| C. | 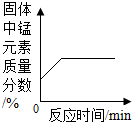 加热一定质量高锰酸钾固体 | |
| D. |  在装有稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子一定由原子构成;原子核一定由质子和中子构成 | |
| B. | 碱中一定含有氢元素;有机物中一定含有碳元素 | |
| C. | 纯净物一定由同种分子构成;生成盐和水的反应一定是中和反应 | |
| D. | 冷却热饱和溶液一定会有晶体析出;溶液中的溶剂一定是水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 农村直接焚烧秸秆肥田 | B. | 大力发展电动汽车,实现节能减排 | ||
| C. | 远离烟草、拒绝毒品 | D. | 改进燃煤炉灶,促进燃料充分燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com