
【题目】实验室中有一包由KCl、MgSO4和CaCl2组成的固体混合物,某校研究性学习小组的同学为了得到纯净的 KCl,设计了如下实验方案:
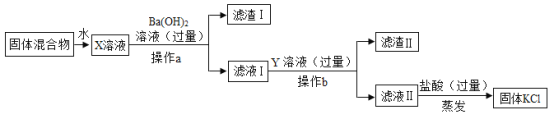
(1)操作a的名称是_____,其中玻璃棒的作用是_____。
(2)加入的Y溶液是_____;写出KCl的一种用途_____。
(3)加入氢氧化钡溶液发生的主要化学反应方程式为_____。
【答案】过滤 引流 K2CO3溶液 作钾肥 ![]()
【解析】
KCl、MgSO4和CaCl2组成的固体混合物溶解形成溶液X,向X溶液中加入过量Ba(OH)2溶液,生成BaSO4和Mg(OH)2沉淀,过滤之后,滤液I中含有KCl、CaCl2、Ba(OH)2,加入过量K2CO3溶液,生成CaCO3和BaCO3沉淀,过滤之后,滤液II中含有KCl、KOH、K2CO3,加入过量盐酸,最后溶液中只含有KCl和盐酸,经过蒸发结晶最终得到KCl固体。
(1)向X溶液中加入过量Ba(OH)2溶液,生成BaSO4和Mg(OH)2沉淀,所以操作a为过滤,将沉淀过滤,得到滤液;玻璃棒在过滤中的作用为引流;
(2)滤液I中含有KCl、CaCl2、Ba(OH)2,加入过量K2CO3溶液,可生成CaCO3和BaCO3沉淀,从而除去钙离子和钡离子;KCl可用作钾肥;
(3)向X溶液中加入过量Ba(OH)2溶液,生成BaSO4和Mg(OH)2沉淀,化学方程式为:![]() 。
。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:初中化学 来源: 题型:
【题目】进行如下微型实验,研究物质的性质。
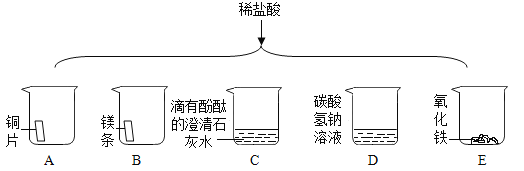
(1)能产生气泡的是_____________(填序号)。
(2)能证明C中发生反应的现象是______________。
(3)有一只烧杯中的物质不与稀盐酸反应,原因是__________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸和碱的中和反应是中学化学中重要的学习内容,在日常生活和工农业生产中有广泛的应用。下图表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线。请从曲线图中获取信息,回答下列问题:
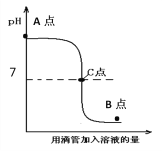
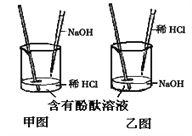
(1)实验操作是按照以上__________(填甲或乙)图所示进行,实验前烧杯中溶液的pH值________7(填 >、< 或 =)。
(2)图中C点表示_______________,图中B点所示溶液中,含有的离子有_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制备并收集二氧化碳
(1)选用药品。按下表进行实验,取等质量的大理石加入足量酸中(杂质不与酸反应), 产生二氧化碳的体积随时间变化曲线如下图所示:

实验编号 | 药品 |
Ⅰ | 块状大理石、10%H2SO4溶液 |
Ⅱ | 块状大理石、7%HCl溶液 |
Ⅲ | 大理石粉末、7%HCl溶液 |
(1)图中丙对应实验_____(填“Ⅰ”、“Ⅱ”或“III”)。确定用乙对应的药品制备并收集二氧化碳,相应的化学方程式是_____;不用甲对应的药品,理由是:_____。
(2)搭建装置。组装可以控制反应速率的装置,应选用_____(填字母)。
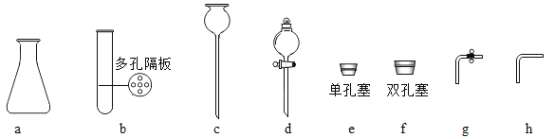
(3)收集气体。用下图装置收集时,空气从_____(填“x”或“y”)端排出。
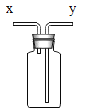
(4)如果用(2)题搭建的装置制取氧气,发生的化学方程式是_____,其中固体物质在此反应中的作用是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】20℃时,向盛有72g水的烧杯中加入18g固体M,充分溶解(如甲所示),进行如图所示实验(不考虑水分蒸发)。下列说法正确的是
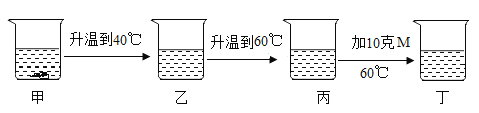
A.甲是饱和溶液,乙是不饱和溶液
B.丙和丁都是不饱和溶液
C.丁中溶液溶质的质量分数为28%
D.M的溶解度随温度的升高而减小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组同学利用pH传感器对碳酸氢钠、碳酸钠的某些性质进行以下探究。
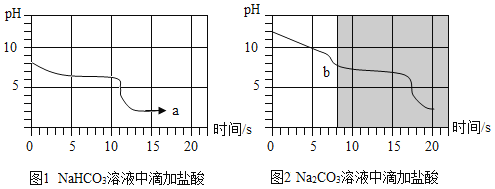
25℃时,向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入相同浓度的盐酸,用pH传感器测得pH变化与时间的关系如图1、图2所示。将图1与图2的阴影部分进行叠加,发现两者基本重合。
回答下列问题:
(1)含等碳原子数的碳酸氢钠和碳酸钠溶液均呈碱性,两种溶液碱性较强的是_____。
(2)a点的溶质为_____,b点前发生反应的化学方程式为_____。
(3)依据实验获取的信息,请将鉴别Na2CO3和 NaHCO3固体的实验方案补充完整:分别取两种固体加入适量水溶解,逐滴缓缓加入稀盐酸,_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硒元素在元素周期表的信息如图,下列说法正确的是
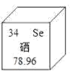
A. 硒原子核内有34个质子 B. 硒属于金属元素
C. 硒的相对原子质量是78.96 g D. 硒的中子数为34
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种物质的溶解度曲线。
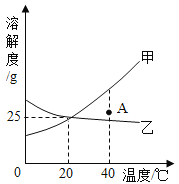
(1)由该图可以看出,甲、乙两种物质中,溶解度随温度升高而增大的物质是____。
(2)甲、乙两种物质的溶解度相等时的温度是____℃,对应饱和溶液溶质质量分数是___。
(3)A点表示甲物质在40 ℃时的不饱和溶液,若在溶质质量不变的情况下,要达到饱和状态需___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸锌主要用作制取颜料立德粉、锌钡白和其他锌化合物的原料,其溶解度随温度变化的曲线如图所示。下列说法正确的是
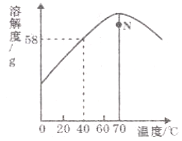
A. ZnSO4的溶解度随温度升高而增大
B. 40℃时,ZnSO4饱和溶液的溶质质量分数为58%
C. 60℃ZnSO4饱和溶液降温至20℃得到不饱和溶液
D. N点对应的ZnSO4溶液升温或降温均有可能析出晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com