
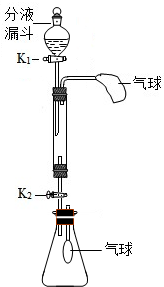
 化学小组同学利用如图装置(固定装置略)按如下操作进行实验,研究酸、碱、盐的性质.玻璃管中盛有氢氧化钠固体,锥形瓶中充满二氧化碳气体.
化学小组同学利用如图装置(固定装置略)按如下操作进行实验,研究酸、碱、盐的性质.玻璃管中盛有氢氧化钠固体,锥形瓶中充满二氧化碳气体.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:初中化学 来源: 题型:
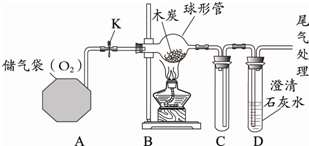 某化学小组同学利用如图所示装置研究可燃物的燃烧条件.
某化学小组同学利用如图所示装置研究可燃物的燃烧条件.| 步骤 | 操作 | 现象 |
| ① | 点燃酒精灯加热 | 无现象 |
| ② | 盖灭酒精灯,待仪器恢复到常温 | 无现象 无现象 |
| ③ | 打开K,向球形管中通入氧气 打开K,向球形管中通入氧气 |
无现象 |
| ④ | 点燃酒精灯加热,继续通氧气 | 木炭燃烧,澄清石灰水变浑浊 木炭燃烧,澄清石灰水变浑浊 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?朝阳区一模)某化学小组同学利用如图所示装置进行实验.
(2013?朝阳区一模)某化学小组同学利用如图所示装置进行实验.
| ||
| 高温高压 |
查看答案和解析>>
科目:初中化学 来源: 题型:
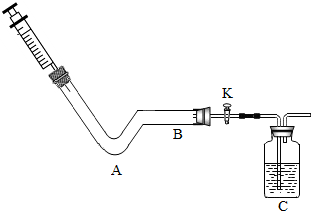 某化学小组同学利用如图所示装置进行实验.
某化学小组同学利用如图所示装置进行实验.查看答案和解析>>
科目:初中化学 来源: 题型:
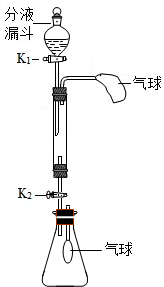 化学小组同学利用如图装置(固定装置略)按如下操作进行实验,研究酸、碱、盐的性质.玻璃管中盛有氢氧化钠固体,锥形瓶中充满二氧化碳气体.
化学小组同学利用如图装置(固定装置略)按如下操作进行实验,研究酸、碱、盐的性质.玻璃管中盛有氢氧化钠固体,锥形瓶中充满二氧化碳气体.查看答案和解析>>
科目:初中化学 来源: 题型:

| 步骤 | 操作 | 现象 | 结论 |
| ① | 点燃酒精灯加热 | 无现象 | 可燃物燃烧需要 |
| ② | 盖灭酒精灯,待仪器恢复到常温 | \ | |
| ③ | 打开K,向球形管中通入氧气 | 无现象 | 可燃物燃烧需要 |
| ④ | 可燃物燃烧需要同时具备上述两个条件才能发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com