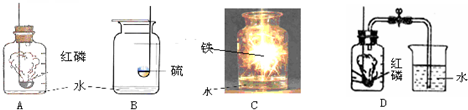
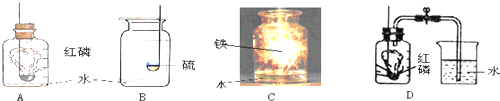
解:(1)在装置B中,若用高锰酸钾制氧气,为防止叫热过程中高锰酸钾进入导气管,试管口应放一团棉花;若用氯酸钾和二氧化锰制氧气,其中的反应物是氯酸钾,反应条件是加热,二氧化锰做催化剂,生成物是氯化钾和氧气,反应方程式是:2KClO
3 
2KCl+3O
2↑.
故答案为:一团棉花; 防止高锰酸钾进入导气管;2KClO
3 
2KCl+3O
2↑.
(2)根据过氧化钠在常温下可与水反应生成氢氧化钠和氧气,可知化学方程式是:2Na
2O
2+2H
2O═4NaOH+O
2↑.
故答案为:2Na
2O
2+2H
2O═4NaOH+O
2↑.
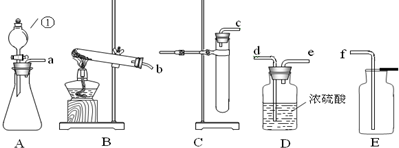
(3)如果在实验室中用A装置作气体发生装置,用过氧化钠和水反应来制取一瓶干燥的氧气,需要用浓硫酸干燥后收集,用浓硫酸干燥时为充分吸收水分,要使气体从长管通入;若只改变A装置中的药品,仍采用已连接的整套装置,说明必须还用固液常温型发生装置和向上排空气法收集装置,所以只能是二氧化碳.
故答案为:adef;二氧化碳.
(4)浓硫酸可以吸收水分干燥气体.
故答案为:干燥气体.
(5)固体质量减少了1.6g,就是生成的氧气的质量.
解:设剩余高锰酸钾的质量为x.
2KMnO
4
K
2MnO
4+MnO
2+O
2↑
316 32
16g-x 1.6g

=
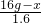
x=0.2g
答:剩余高锰酸钾的质量为0.2g.
分析:(1)根据用高锰酸钾制取氧气的实验的注意事项分析;根据用氯酸钾和二氧化锰制氧气的反应物、反应条件、生成物写出化学反应式.
(2)根据信息:已知过氧化钠(Na
2O
2)是一种淡黄色固体,常温下可与水反应生成氢氧化钠和氧气,写出化学方程式.
(3)用过氧化钠和水反应来制取一瓶干燥的氧气,需要用浓硫酸干燥后收集,用浓硫酸干燥时为充分吸收水分,要使气体从长管通入.
(4)浓硫酸可以吸收水分干燥气体.
(5)根据高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,可知由于氧气的放出而使加热一段时间后试管内固体质量减少,因此固体减少的质量就是生成的氧气的质量,然后利用反应中各物质的质量关系计算出试管中剩余高锰酸钾的质量.
点评:实验室制取氧气的实验是初中化学的重点实验,关于实验中的注意事项、化学方程式的书写、实验装置的连接、有关计算等问题都是考查的重点内容,对于与之相关问题同学们一定要了然于心.

 2KCl+3O2↑.
2KCl+3O2↑. 2KCl+3O2↑.
2KCl+3O2↑. K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑  =
=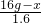


 (2012?天河区一模)(1)CO还原氧化铜的化学方程式是
(2012?天河区一模)(1)CO还原氧化铜的化学方程式是