向8gFe2O3通入CO高温加热一段时间后,称得剩余固体为6.8g,求剩余固体由什么成分组成,其质量为多少?
解:反应前后氧化铁与铁的相对分子质量差,与两物质质量的差成比例
设生成的铁的质量是x,反应的氧化铁质量是y
3CO+Fe
2O
3
2Fe+3CO
2 差量
160 112 48
y x 8g-6.8g
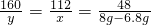
x=2.8g y=4g
所以剩余固体是未反应的氧化铁和反应生成的铁,其质量分别是8g-4g=4g和2.8g;
答:剩余固体由氧化铁和铁组成,其质量分别为4g和2.8g;
分析:此题是一道利用差量法解决的典型题目,根据反应时氧化铁与铁的相对分子质量差,列出比例进行求解即可.
点评:此题是一道差量法解题的典型题目,解题的关键是找到相关的量差,列出比例式进行求解.
