
(6分)把6.5g 锌放入到50g 硫酸溶液恰好完全反应。计算:
可制得氢气多少克?
这种硫酸溶液中溶质的质量分数是多少?
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:计算题
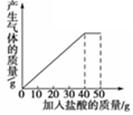
石灰石样品的主要成分是CaCO3(已知其它杂质不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(5分)某石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4 g石灰石样品,把20 g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:
| 次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 稀盐酸的用量 | 5 g | 5 g | 5g | 5g |
| 剩余固体的质量 | 3 g | 2 g | 1 g | 1 g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(4分)我国约在南北朝时就开始炼制黄铜,黄铜是铜和锌的合金,它可用来制造机器、电器零件及日用品,为了测定某黄铜中铜的质量分数,取10g黄铜加入到50g稀硫酸中,恰好完全反应,产生氢气0.1g,试求:
(1)该黄铜样品中铜的质量分数。
(2)原稀硫酸溶液中溶质的质量分数。
(温馨提示:解答时,要有必要的文字说明和计算步骤等,只写最后结果不给分)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小明在老师的指导下粗略测量一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数约为1%的氢氧化钠溶液。
步骤二:向10克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使
用pH计记录溶液的pH变化情况,绘制图像如图。
(1)在“步骤一”中有计算、 、溶解三个具体步骤。
(2)在往稀盐酸中逐渐滴入氢氧化钠溶液的过程中,在a点的溶液中
的微粒有 。(用化学符号表示)
(3)请结合右图,计算①该稀盐酸的溶质质量分数;②b点时溶液中溶质的质量分数。(结果精确到0.1%)(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)硅(Si)是太阳能电池和电脑芯片中不可缺少的材料。硅生产过程中的一个重要化学反应为SiO2 + 2C 高温 Si + 2CO↑。若生产5.6 g硅,理论上需要二氧化硅(SiO2)多少克?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(8分)石灰石的主要成分为CaCO3(其余杂质不溶于水,亦不参加反应)。某化学兴趣小组为了测定石灰石中CaCO3的质量分数,进行了以下探究实验:称石灰石样品二份,分别放入大烧杯中,第一个烧杯中加入50克稀盐酸,第二个烧杯中放入100克稀盐酸,充分反应至不再有气泡产生时称量残留物质量,有关数据如下表。求:(1)二个烧杯中CO2的质量;(2)石灰石样品中CaCO3的质量分数;(3)稀盐酸中溶质的质量分数。
| 各物质的质量 | 第一个烧杯 | 第二个烧杯 |
| 样品质量 | 16g | 16 g |
| 稀盐酸质量 | 50g | 100g |
| 烧杯残留物质量 | 61.6 g | 109.4g |
| 产生的CO2质量 | | |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)为了测定某产品中碳酸钡的质量分数进行了如下实验。取一定量的样品和400g溶质质量分数为10%的稀盐酸放入烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录如下表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25.4g)
| 反应时间 | t1 | t2 | t3 | t4 | t5 |
| 烧杯和药品质量/g | 516.6 | 507.8 | m | 503.4 | 503.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室制取氢气的化学方程式是Zn+H2SO4═ZnSO4+H2↑;今有40g质量分数为30%的硫酸溶液,加水稀释至120g,取出稀释后的溶液5g,试计算,这5g溶液的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com