
| A. | 煤燃烧时向煤炉中鼓入空气 | B. | 面团发酵时放在温热处 | ||
| C. | 某些食品密封包装时充入氮气 | D. | 用双氧水制氧气加入二氧化锰 |
分析 根据温度、浓度、催化剂、接触面积对反应速率有较大的影响;一般来说,增大浓度、增大压强、升高温度、加入催化剂或增大固体的表面积,可增大反应速率,反之反应速率减小.
解答 解:A、煤燃烧时向煤炉中鼓入空气,增大了氧气的浓度,燃烧更充分,反应速率加快,故选项错误.
B、面团发酵时放在温热处,温度较高,加快了化学反应速率,故选项错误.
C、某些食品密封包装时充入氮气,氮气的化学性质不活泼,能作保护气,可以防止食品与氧气的接触,减慢了反应速率,故选项正确.
D、用双氧水制氧气加入二氧化锰,二氧化锰作催化剂,加快了化学反应的速率,故选项错误.
故选:C.
点评 本题难度不大,本题考查影响反应速率的因素,了解温度、浓度、催化剂、接触面积对反应速率的影响是正确解答本题的关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 主要物质(杂质) | 化学方程式(或方法) |
| FeSO4(CuSO4) | |
| KCl(K2CO3) | |
| KCl(K2SO4) | |
| CO2(CO) | |
| CO(CO2) | |
| NaNO3(CuSO4) | |
| KNO3(NaCl) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
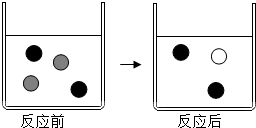 向AgNO3溶液中加入过量的铜粉充分反应,回答下列问题:
向AgNO3溶液中加入过量的铜粉充分反应,回答下列问题: Ag+、
Ag+、 Cu2+.
Cu2+.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 高岭土属于混合物 | |
| B. | 高岭土的主要成分是由四种元素组成的 | |
| C. | 高岭土的主要成分中硅元素的化合价为+4 | |
| D. | 高岭土的主要成分中铝元素的质量分数最小 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 风助火威--为燃烧提供足够多的氧气 | |
| B. | 杯水车薪一水少了不能降低温度使温度低于可燃物的着火点 | |
| C. | 釜底袖薪一隔离可燃物可以灭火 | |
| D. | 水火不容--用水可以灭火,是因为降低了可燃物的着火点 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.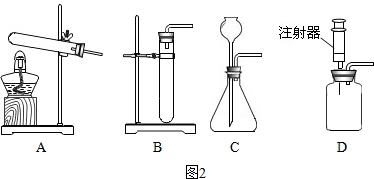
| 盐酸 | 大理石 | 温度条件 |
| 5% | 细颗粒 | 20℃ |
| 10% | 粗颗粒 | 40℃ |
| 每次用量均20mL | 每次用量均5g |
| 实验编号 | 温度 | 大理石规格 | HCl浓度 | 探究目的 |
| ① | 20℃ | 粗颗粒 | 5% | (I)实验①和②探究浓度对反应快慢的影响; (II)实验②和④探究温度对反应快慢的影响; (III)实验①和③③探究大理石粗、细对反应快慢的影响. |
| ② | 20℃ | 粗颗粒 | 10% | |
| ③ | 20℃ | 细颗粒 | 5% | |
| ④ | 40℃ | 粗颗粒 | 10% |
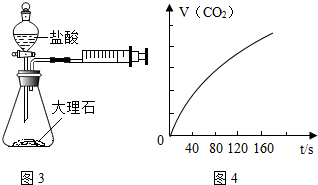 实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com