

 2KCl+3O2↑
2KCl+3O2↑ 解得X=9.6g;
解得X=9.6g; 2KCl+3O2↑;2H2O2
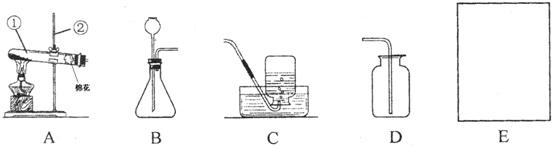
2KCl+3O2↑;2H2O2 2H2O+O2↑;(3)分解 化学性质;(4)9.6(5)E 将带火星的木条靠近集气瓶口,若木条迅速复燃,则证明已收集满氧气.
2H2O+O2↑;(3)分解 化学性质;(4)9.6(5)E 将带火星的木条靠近集气瓶口,若木条迅速复燃,则证明已收集满氧气.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:

| 加热 |
| 加热 |
| 二氧化锰 |
| 二氧化锰 |
| 点燃 |
| 点燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:
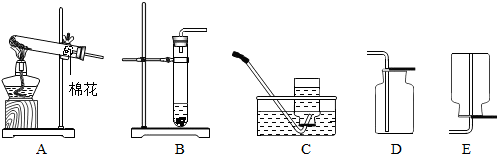
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com