
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案。
(1)实验准备:(1)用98%的浓硫酸配制l0%的硫酸溶液。现有烧杯、玻璃棒、量筒, 还需要的仪器有 ;
【方案一】在等质量的镁条和铝片的两支试管中,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明 。
[反思]:有的同学认为这种方案不够合理,理由是_________________________________。
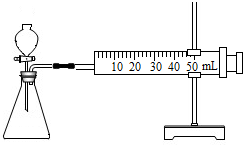
【方案二】(1)连接仪器组装成如右图所示实验装置。某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,你认为该装置是否漏气? 。
(2)依次进行镁、铝与硫酸反应,写出镁与硫酸反应的化学方程式: ;
要比较两种金属活动性强弱,可以测定两种金属硫酸反应得到相同体积氢气所需要的时间;还可测定 。
[拓展] 镁与铝分别与足量的质量分数为l0%稀硫酸反应,如制得相同质量的氢气,则镁与铝的质量比为 。(2分)
【方案三】请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱:
(1)胶头滴管 镁的活动性比铝强
镁条和铝片的形状不一样,跟硫酸的接触面积可能不同 不漏气
(2) Mg + H2SO4 = MgSO4 +H2↑相同时间内两种金属制得的氢气的体积24︰18 或4:3(2分)
取同样大小、形状的镁条和铝条,打磨后,在酒精灯上加热,镁条很快燃烧起来,而铝条不能燃烧,说明镁的活动性比铝强
解析试题分析:(1)实验准备:(1)用98%的浓硫酸配制l0%的硫酸溶液。现有烧杯、玻璃棒、量筒, 还需要的仪器有胶头滴管;
【方案一】在等质量的镁条和铝片的两支试管中,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明镁的活动性比铝强。
[反思]:有的同学认为这种方案不够合理,理由是镁条和铝片的形状不一样,跟硫酸的接触面积可能不同。
【方案二】(1)如图所示实验装置中,若某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,则该装置不漏气。
(2)依次进行镁、铝与硫酸反应,镁与硫酸反应的化学方程式为:Mg + H2SO4 = MgSO4 +H2↑;
要比较两种金属活动性强弱,可以测定两种金属硫酸反应得到相同体积氢气所需要的时间;还可测定相同时间内两种金属制得的氢气的体积。
[拓展] 镁与铝分别与足量的质量分数为l0%稀硫酸反应,如制得相同质量(Ag)的氢气,则镁与铝的质量分别为为X和Y:
Mg + H2SO4 = MgSO4 +H2↑
24 2
X Ag
24:2=X:Ag
A=12Ag
2Al + 3H2SO4 = Al2(SO4)3+3H2↑
54 6
Y Ag
54:6=Y:Ag
Y=9Ag
X:Y=12Ag:9Ag=4:3
考点:配置一定质量分数的溶液;金属活动性;化学方程式的书写;根据化学方程式计算。
点评:本题综合性较强,难度较大,考查了配置一定质量分数的溶液、金属活动性顺序、根据化学方程式计算等内容。其中根据化学方程式计算,要注意解题的步骤,即设、写、找、列、解、答六个步骤。


科目:初中化学 来源: 题型:阅读理解
 某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.实验准备:
某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.实验准备:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2012?南通)某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.
(2012?南通)某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案.查看答案和解析>>
科目:初中化学 来源:2012年初中毕业升学考试(江苏南通卷)化学(带解析) 题型:探究题
(9分)(2012?南通)某化学学习小组为比较镁和铝的金属活动性强弱设计了如下实验方案。
实验准备:
(1)用98%的浓硫酸配制l0%的硫酸溶液.现有烧杯、玻璃棒、胶头滴管,还 需要的仪器有 _________ ;在稀释时,一定要 _________ ,并不断搅拌.
(2)准备两块表面积相同的镁条和铝条,并除去表面的氧化膜.要求两种金属片表面积相同的原因是 _________ .
【方案一】将除去氧化膜的镁条、铝条,分别与相同体积相同质量分数的硫酸反应,观察到镁比铝反应更剧烈,说明 _________ .
【方案二】
(1)连接仪器组装成如右图所示实验装置.某学生用抽拉法检查该装置的气密性,发现被拉出的针筒活塞一段时间后又回到原来的位置,你认为该装置是否漏气? _________ .
(2)依次进行镁、铝与硫酸反应,写出镁与硫酸反应的化学方程式: _________ ;要比较两种金属活动性强弱,可以测定两种金属与硫酸反应得到相同体积氢气所需要的时间;还可测定 _________ .
【方案三】请设计一个与上述实验不同的方案,比较镁和铝的金属活动性强弱: _________ .
查看答案和解析>>
科目:初中化学 来源:江苏中考真题 题型:实验题

查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省扬州市邢江区美琪学校九年级(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com