
分析 根据通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;高锰酸钾受热时能够分解生成锰酸钾、二氧化锰和氧气; 氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气解答;
解答 解:在实验室里,常采用分解过氧化氢溶液、加热高锰酸钾或加热氯酸钾的方法制取氧气.当用过氧化氢溶液或在加热氯酸钾制氧气时,通常加入二氧化锰,二氧化锰是反应的催化剂,起催化作用,反应完成后,把二氧化锰分离出来,可以发现分离出来的二氧化锰和原来的二氧化锰相比质量和化学性质都没有发生改变.
答案:过氧化氢;高锰酸钾或加热氯酸钾;过氧化氢溶液或在加热氯酸钾;催化;质量;化学性质.
点评 催化剂能改变化学反应速度,但质量和化学性质在化学反应前后不变,即一变两不变.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷 | B. | 氧化镁 | C. | 硫 | D. | 碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 H7N9禽流感,使人们谈“禽”色变.从香料八角中提取的莽草酸是合成治疗禽流感药物--达菲的原料.莽草酸为白色粉末,熔点191℃,气味辛酸,易溶于水,能与紫色石蕊溶液反应而使其变红.如图是莽草酸的结构模型,下列选项不正确的是( )
H7N9禽流感,使人们谈“禽”色变.从香料八角中提取的莽草酸是合成治疗禽流感药物--达菲的原料.莽草酸为白色粉末,熔点191℃,气味辛酸,易溶于水,能与紫色石蕊溶液反应而使其变红.如图是莽草酸的结构模型,下列选项不正确的是( )| A. | 莽草酸的化学式为C7H10O5 | |
| B. | 莽草酸分子中含有5个水分子 | |
| C. | 熔点191℃,气味辛酸,属于莽草酸的物理性质 | |
| D. | 莽草酸中含有碳、氧、氢三种元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 常温下,木炭与氧气不反应 | |
| B. | 液氧和固态氧都是无色的 | |
| C. | 在通常情况下,氧气就能和所有的物质反应 | |
| D. | 鱼能在水中生存,说明氧气易溶于水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氮气是一种溶于水的气体,它的性质不如氧气活泼 | |
| B. | 工业上常用稀有气体做保护气,例如:电弧焊接铝合金时,用氩气做保护气 | |
| C. | 氮气和二氧化碳都是无色的气体,可用澄清的石灰水区别这两种气体 | |
| D. | 汽车排气所形成的烟雾是城市空气的主要污染源之一 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
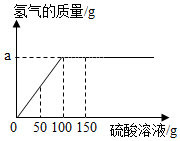 某学生为测定某铜锌合金中锌的纯度,实验方法是:取合金样品10克放入烧杯中,然后向烧杯里逐滴滴入稀硫酸溶液,到不再产生气体后,将溶液过滤,将固体洗涤烘干后,称得固体质量为3.5g,反应情况如图所示.【提示:铜不与稀硫酸溶液反应;锌与硫酸反应方程式为Zn+H2SO4=H2↑+ZnSO4】请根据图示和信息计算:
某学生为测定某铜锌合金中锌的纯度,实验方法是:取合金样品10克放入烧杯中,然后向烧杯里逐滴滴入稀硫酸溶液,到不再产生气体后,将溶液过滤,将固体洗涤烘干后,称得固体质量为3.5g,反应情况如图所示.【提示:铜不与稀硫酸溶液反应;锌与硫酸反应方程式为Zn+H2SO4=H2↑+ZnSO4】请根据图示和信息计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com