
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
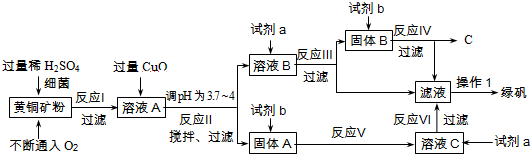
分析 (1)根据黄铁矿和稀硫酸反应生成硫酸铜、硫酸铜,以及加入的硫酸是过量的进行分析;
根据固体A的成分是氧化铜和氢氧化铁,酸会与金属氧化物和不溶性碱反应,所以a是稀硫酸进行分析;
(2)根据氢氧化铜、氢氧化铁沉淀时的pH值进行分析;
(3)根据硫酸铜和铁反应生成硫酸亚铁和铜进行分析;
(4)根据从溶液中的到晶体的方法进行分析.
解答 解:(1)黄铜矿和稀硫酸反应生成硫酸铜、硫酸铜,以及加入的硫酸是过量的,所以溶液A的成分为H2SO4、CuSO4、Fe2(SO4)3;
固体A的成分是氧化铜和氢氧化铁,酸会与金属氧化物和不溶性碱反应,所以a是稀硫酸;
(2)通过分析氢氧化铜、氢氧化铁沉淀时的pH值可知,反应Ⅱ中加CuO调pH为3.7~4的目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀;
(3)硫酸铜和铁反应生成硫酸亚铁和铜,化学方程式为:CuSO4+Fe=Cu+FeSO4;
(4)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为蒸发浓缩、冷却结晶、过滤.
故答案为:(1)H2SO4、CuSO4、Fe2(SO4)3,稀硫酸(或稀H2SO4);
(2)使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀;
(3)CuSO4+Fe=Cu+FeSO4;
(4)蒸发浓缩、冷却结晶.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.


 高中必刷题系列答案
高中必刷题系列答案科目:初中化学 来源: 题型:选择题

| A. | t2℃时将50g 甲配制成的饱和溶液降温至t1℃时,理论上得到溶液质量是130g | |
| B. | t1℃时乙的饱和溶液(溶液中无晶体)升温到t2℃时,溶质质量分数不变 | |
| C. | t1℃时,等质量的甲和乙的溶液中含溶质质量相等 | |
| D. | t1℃时,甲和乙的饱和溶液蒸发等量的水,析出晶体质量相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 今年5月12日是我国第八个“防灾减灾日”,主题是“减少灾害风险 建设安全城市”.下列做法不合理的是( )
今年5月12日是我国第八个“防灾减灾日”,主题是“减少灾害风险 建设安全城市”.下列做法不合理的是( )| A. | 扑灭森林火灾,可将大火蔓延路线前的一片树木砍掉,形成隔离带 | |
| B. | 室内电器着火,先切断电源,再用灭火器灭火 | |
| C. | 把燃气热水器安装在浴室内 | |
| D. | 油库、面粉加工厂、纺织厂等场所要严禁烟火 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 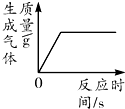 加热一定质量的高锰酸钾制取氧气 | |
| B. | 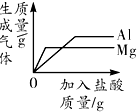 向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸 | |
| C. | 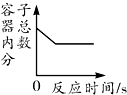 氢气和过量的氧气在密闭容器中完全反应 | |
| D. |  向一定质量的氯化铁和稀盐酸的混合溶液中逐滴滴加氢氧化钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com