
【题目】(1)黄铜是___________(填“Cu-Ag”或“Cu-Zn”)的合金。
(2)小桦和小杰对黄铜的成分产生兴趣,他俩决定对黄铜中的铜元素含量进行测定探究:
小桦称取10g黄铜样品,量取60g质量分数为14.6%的稀盐酸平均分成六等份,分别加入到盛有黄铜的烧杯中,当小杰观察到无气泡冒出时记录了以下表格数据:
次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加稀盐酸质量(g) | 10 | 20 | 30 | 40 | 50 | 60 |
烧杯中固体质量(g) | 8.7 | 7.4 | 6.1 | 4.8 | 3.5 | 3.5 |
请回答下列问题:
①当反应到无气泡冒出时,所消耗的稀盐酸是____________g。
②生成氢气为多少_______ g?(写出计算过程)
③黄铜中铜元素的质量分数是_________________。
④画出黄铜的质量随加入稀盐酸的变化关系图:____________
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:初中化学 来源: 题型:
【题目】化学用语是学习化学的基本工具,请用正确的化学符号填空。
(1)水中氢的化合价_______(2)干冰 ________(3)2个碳酸根离子______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是实验室中常用的仪器:
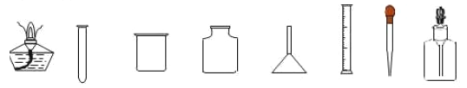
(1)做硫粉在氧气中燃烧实验时使用的玻璃仪器是 ____________(填仪器名称)
(2)用来吸取和滴加少量液体时,需要用到的仪器是 _________(填仪器名称)
(3)上图中可以直接加热的仪器是 _________(填仪器名称)
(4)某同学用50mL的量筒量取一定体积的液体。倾倒液体时,标签要向着手心,目的是________; 读数时,视线要与量筒内__________保持水平;如果该同学仰视读数为44 mL,则量筒内液体实际体积_____44 mL(选填“大于”或“小于”或 “等于”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合图示实验装置,回答下列问题。
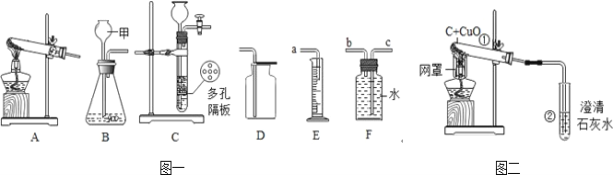
(1)实验室加热高锰酸钾制取氧气应选用的发生装置为___________(填字母),试管中棉花的作用是______________。
(2)若选B装置作为实验室制取氧气的发生装置,反应的化学方程式为:___________,某同学用D装置收集氧气,验满方法是___________。
(3)实验室可用B或C装置制二氧化碳,选用C相对于B装置的主要优点是___________。
(4)某同学用E、F装置收集一定量的氧气,装置接口连接的顺序为___________(填接口字母),量筒的作用是___________。
(5)图二中,酒精灯加网罩的目的___________。试管①中发生反应的化学方程式为:___________。
(6)图二实验停止加热时,应先将导管从试管②中撤出,并用弹簧夹夹紧橡皮管,待试管①冷却后再把试管里的粉末倒出,这样操作的原因是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
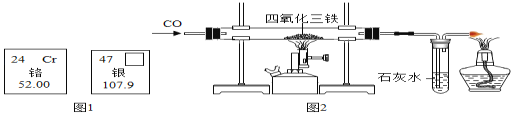
【题目】人类目前发现一百多种元素中金属占了大多数.
(1)如图是两种金属元素在周期表中的信息,请回答下列问题:铬的相对原子质量为_____,图中方框内填的是_____.
(2)我国在春秋战国时期就开始冶铁和炼钢.实验室根据工业冶铁的原理设计了如图的装置进行实验.请回答:主要成分为四氧化三铁的矿石的名称是_____,图中玻璃管内发生的化学反应方程式为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】题短分好骗,空空请珍重,请用化学用语表示:
(1)碳酸钾中的阴离子____________(2)4个铵根离子___________(3)2个铝离子__________
(4)氧化镁中镁元素的化合价__________ (5)二氧化硅______(6)硫酸钠_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题。
(1)镁条在空气完全燃烧后生成氧化镁(只考虑氧气参加反应,下同),化学方程式为_____,若固体质量变化用图1表示,则m2与m1之差表示_____的质量。
(2)实验过程中,镁条点燃后实验现象如图2所示,镁条完全燃烧后,称量得知石棉网上流下固体质量反而比反应前镁条还轻,其原因可能是_____。
(3)若使该实验符合质量守恒定律,则应将该实验在_____条件中进行。
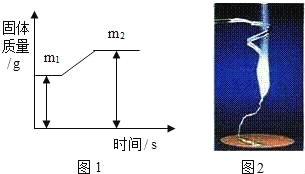
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某粒子的结构示意图,下列有关该粒子的说法错误的是
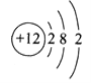
A. 该粒子的原子核内有12个质子
B. 该粒子带12个单位的正电荷
C. 该粒子的原子核外有3个电子层
D. 该粒子在化学反应中易失去2个电子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】煤是社会生产、生活中最重要的能源,工业上常把煤进行气化和液化处理,使煤变成清洁能源。煤气化和液化流程示意图如下图所示,请结合图像回答问题:
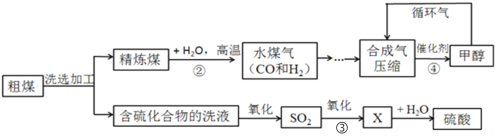
(1)精炼煤中主要成分是碳,步骤②中发生反应的化学方程式为__________。
(2)步骤③中,SO2进一步氧化得到X,X为硫的另一种氧化物,其中硫元素的化合价为+6价,X的化学式为________。
(3)经过进一步净化,含较多杂质的水煤气转化为合成气(CO和H2的混合气体),步骤④中生成的甲醇(CH3OH)是一种重要的化工原料,该反应的化学方程式为_________,该反应的基本类型是 _________。
(4)循环气的主要成分是__________和少量未完全分离出去的甲醇。
(5)从“绿色化学”的角度分析,“煤的气化和液化”流程的优点:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com