

 ×100%;
×100%;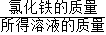 ×100%,因此需要根据氧化铁质量计算反应生成氯化铁的质量及参加反应的盐酸的质量;溶液的质量利用物质质量守恒定律进行计算.
×100%,因此需要根据氧化铁质量计算反应生成氯化铁的质量及参加反应的盐酸的质量;溶液的质量利用物质质量守恒定律进行计算.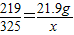 ;
;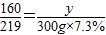
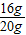 ×100%=80%.
×100%=80%.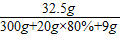 ×100%=10%.
×100%=10%.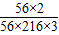 ÷80%=120t.
÷80%=120t.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?哈尔滨一模)张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与酸反应,也不溶于水).
(2012?哈尔滨一模)张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与酸反应,也不溶于水).| 219 |
| 325 |
| 21.9g |
| x |
| 219 |
| 325 |
| 21.9g |
| x |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
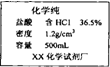 张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与酸反应,也不溶于水).
张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与酸反应,也不溶于水).查看答案和解析>>
科目:初中化学 来源: 题型:
张南同学想测定某赤铁矿样品中氧化铁的质量分数,做法如下.请回答下列问题(假设赤铁矿样品中杂质不与酸反应,也不溶于水)。
(1)配制稀盐酸,配制400g7.3%的稀盐酸.需要如标签上标注的浓盐酸的质量是_______________
(2)将赤铁矿粉末与稀盐酸混合,反应的化学方程式是 ______________________________
(3)取20g的赤铁矿粉与300g的7.3%的稀盐酸恰好完全反应,求解生成氯化铁质量X的比例式为______________________________
(4)此赤铁矿中氧化铁的质量分数为_______________
(5)向!反应后所得溶液中加入9g水,则最终所得溶液中溶质的质量分数是_______________
(6)若用上述赤铁矿冶炼生铁63t,生铁中杂质含量为4%,炼铁过程中生铁的损失率为20%,求解需要此矿石的质量为:_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com