
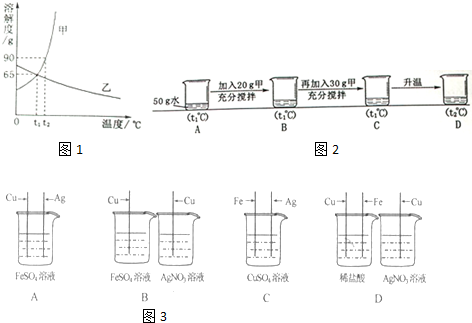
分析 (1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)根据物质的溶解度曲线可以判断物质的溶解度随温度变化情况;
(3)根据物质的溶解度随温度变化情况可分析提纯物质的方法;
(4)据饱和溶液中溶质的质量分数计算方法及甲乙溶解度随温度变化情况分析解答;
(5)根据加入物质的质量和不同温度下甲的溶解度分析判断;
向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出,可能是甲溶于水时放热.
解答 解:(1)t1℃时,甲、乙两种物质的溶解度相等;
(2)由图可知:乙的溶解度随温度升高而减小;
(3)降低温度适合溶解度随温度升高而增大且受温度影响大的固体,t1℃时甲的溶解度是65g,t2℃时甲的溶解度是90g;说明甲的溶解度随温度的升高而增大,所以可使甲物质从其饱和溶液中结晶析出的方法是降低温度;
(4)从题中信息可知:t1℃时二者的溶解度相等,据饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%可知溶解度相等则溶质的质量分数相等,升温后甲的溶解度增大,溶液中溶质、溶剂的质量不变,溶质的质量分数不变,乙的溶解度减小,析出晶体,溶质的质量分数减小,所以升温后甲的质量分数大于乙;
(5)①在t1℃时二者的溶解度是65g,即100g水最多溶解甲、乙都是65g,该温度下50g水中溶解32.5g甲才饱和,所以图中B溶解20g甲得到的是甲的不饱和溶液;C中一共加入50g甲只能溶解32.5g,所以得到的C是饱和溶液;t2℃时100g水最多溶解甲是90g所以该温度下50g水中最多溶解45g,一共加入50g甲不能全部溶解得到的是饱和溶液;
②在t1℃时100g水最多溶解甲、乙都是65g,该温度下50g水中溶解32.5g甲就饱和,温度不变的话50g甲不能全溶,却发现固体全部溶解,一段时间后又有部分固体析出,而甲的溶解度随温度的升高而增大所以开始能全溶说明温度升高,说明甲溶于水放热使温度升高固体溶解,温度冷却后溶解度减小又析出固体;
故答案:(1)t1;(2)乙;(3)降低温度;(4)大于;(5)①B;②甲溶于水时放出热量.
点评 掌握溶解度的基本概念、溶解度曲线的意义、分离物质的方法等知识是解答该题的关键,能较好考查学生分析、解决问题的能力.


 步步高达标卷系列答案
步步高达标卷系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
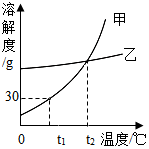 如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )| A. | t2℃时甲的饱和溶液降温至t1℃变为不饱和溶液 | |
| B. | t1℃时,50g甲的饱和溶液中有15g甲 | |
| C. | t2℃时,甲、乙两物质溶液中溶质的质量分数相等 | |
| D. | 当甲中含有少量乙时,可以用降温结晶的方法提纯甲 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
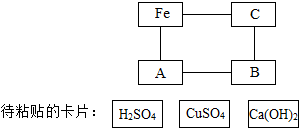
 框图中A是人体胃液中含有的成分,B用于改良酸性土壤,G是铁锈的主要成分(Fe2O3•xH2O),I是能使湿润红色石蕊试纸变蓝的气体.根据图示回答下列问题.
框图中A是人体胃液中含有的成分,B用于改良酸性土壤,G是铁锈的主要成分(Fe2O3•xH2O),I是能使湿润红色石蕊试纸变蓝的气体.根据图示回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子是化学变化中的最小粒子 | |
| B. | 保持水的化学性质的最小微粒是氢原子和氧原子 | |
| C. | 原子的质量主要集中在原子核上 | |
| D. | 分子、原子、离子都可以直接构成物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 图是化学园地中一张表示物质间反应关系的卡片图(“--”表示相连的两种物质能够在溶液体系中发生化学反应),其中A、B、C三处的卡片尚未粘贴.
图是化学园地中一张表示物质间反应关系的卡片图(“--”表示相连的两种物质能够在溶液体系中发生化学反应),其中A、B、C三处的卡片尚未粘贴.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com