
| 选项 | 实验目的 | 实验操作 |
| A | 除去CO2中少量的CO | 点燃 |
| B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉,过滤 |
| C | 鉴别澄清石灰水和NaOH溶液 | 加入稀盐酸 |
| D | 鉴别硬水和软水 | 加入肥皂水 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
B、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
C、根据两种物质与同种试剂反应产生的不同现象来鉴别它们,若两种物质与同种物质反应的现象相同,则无法鉴别它们.
D、硬水和软水的区别在于所含的钙镁离子的多少,进行分析判断.
解答 解:A、除去二氧化碳中的一氧化碳不能够点燃,这是因为会引入新的气体杂质,且当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的一氧化碳是不会燃烧的;故选项实验操作不能达到实验目的.
B、铜的金属活动性比铁弱,足量的铜粉不能与硫酸亚铁溶液反应,不能除去杂质,故选项实验操作不能达到实验目的.
C、澄清石灰水和NaOH溶液均能与稀盐酸反应,分别生成氯化钙和水、氯化钠和水,均无明显变化,不能鉴别,故选项实验操作不能达到实验目的.
D、硬水和软水的区别在于所含的钙镁离子的多少,可用肥皂水来区分硬水和软水,加入肥皂水,若产生泡沫较多,则是软水,若产生泡沫较少,则是硬水;故选项实验操作能达到实验目的.
故选:D.
点评 本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体解题时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.


科目:初中化学 来源: 题型:选择题
| A. | 单质:水、氢气、氧气 | B. | 氧化物:水、二氧化碳、硫酸铜 | ||
| C. | 混合物:煤、石油、冰水共存物 | D. | 还原剂:氢气、碳、一氧化碳 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
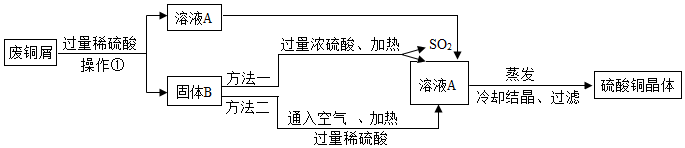
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
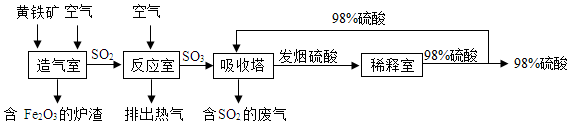
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
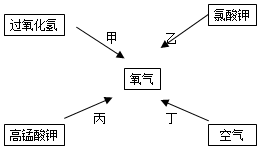 图示四种途径都可以得到氧气:
图示四种途径都可以得到氧气:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com