
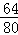 ×100%=40g;
×100%=40g; =
=
 =
=
 ×100%=72g;
×100%=72g;

科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
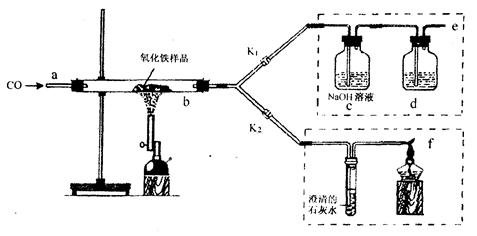
| A.澄清石灰水 | B.水 | C.石蕊溶液 | D.浓硫酸 |
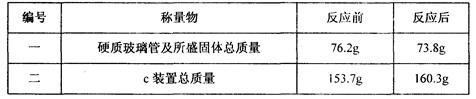
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.NH4HCO3 | B.(NH4)2SO4 | C.CO(NH2)2 | D.NH4Cl |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| | 烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ |
| 加入10.0%氯化钙溶液的质量(g) | 55.5 | 120.0 | 150.0 |
| 白色固体的质量(g) | 5.0 | 10.0 | 10.0 |

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.1.2g | B. 2.0g | C.2.2g | D.1.9g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com