解:(1)纯碱属于盐,制取烧碱必须是碱和盐反应生成新碱和新盐,需要用氧化钙制取碱,氧化钙与水反应生成氢氧化钙,所以X是水,化学式为H
2O;
(2)碳酸钙高温分解的反应物是碳酸钙写在等号的左边,生成物氧化钙和二氧化碳写在等号的右边,二氧化碳后面标上上升符号,其方程式为:CaCO
3
CaO+CO
2↑;
(3)由于氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所以废泥的主要成份是碳酸钙;由图示可知A物质是过量,所以氢氧化钙是过量的,滤液中会混有氢氧化钙;(4)如果不慎将碱液沾到皮肤上,可用较多的水冲洗,再涂上稀硼酸溶液对碱液进行中和,从而减轻碱液对皮肤的腐蚀;
(5)设与氢氧化钠反应消耗氯化氢的质量为X则:
NaOH+HCl═NaCl+H
2O
40 36.5
16.0g×10% X
根据:
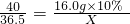
解得X=1.46g,

×100%=7.3%.
故答案为:(1)H
2O;(2)CaCO
3
CaO+CO
2↑;(3)CaCO
3,Ca(OH)
2;(4)硼酸或醋酸;(5)7.3%.
分析:由图示的过程可知利用氧化钙和纯碱制取氢氧化钙的过程是:氧化钙与水反应生成氢氧化钙,氢氧化钙再与碳酸钠反应生成碳酸钙和氢氧化钠,过滤得氢氧化钠的溶液,进行蒸发操作后可得氢氧化钠固体,据此对过程进行分析判断即可
点评:此题是一道框题推断分析题,其主干就是工业上制取烧碱的方法,只要能依据氢氧化钠是由碳酸钠和氢氧化钙制取的原理进行分析,即可得相应的问题答案


 CaO+CO2↑;
CaO+CO2↑;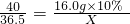 解得X=1.46g,
解得X=1.46g, ×100%=7.3%.
×100%=7.3%. CaO+CO2↑;(3)CaCO3,Ca(OH)2;(4)硼酸或醋酸;(5)7.3%.
CaO+CO2↑;(3)CaCO3,Ca(OH)2;(4)硼酸或醋酸;(5)7.3%.





