
在高温密闭的容器中使碳和氧气充分反应,碳无剩余.若
a是氧气和碳的质量比值.要使密闭容器中只含有 和CO两种气体,则a是
和CO两种气体,则a是
[
]|
A .4/3<a<8/3 |
B .a=8/3 |
|
C .3/8<a<3/4 |
D .a=4/3 |
科目:初中化学 来源: 题型:阅读理解
| ||
| ||


查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| 100 |
| x |
| 56 |
| 6.04g |
| 10.78 |
| 10 |
查看答案和解析>>
科目:初中化学 来源:化学教研室 题型:013
在高温密闭的容器中使碳和氧气充分反应,碳无剩余.若
a是氧气和碳的质量比值.要使密闭容器中只含有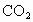 和CO两种气体,则a是
和CO两种气体,则a是
[
]|
A .4/3<a<8/3 |
B .a=8/3 |
|
C .3/8<a<3/4 |
D .a=4/3 |
查看答案和解析>>
科目:初中化学 来源:2005年广西玉林市中考化学试卷(解析版) 题型:解答题
 CaO+CO2↑
CaO+CO2↑ x=lO.78g
x=lO.78g  ×100%=107.8%
×100%=107.8%查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com