
| 106 |
| x |
| 117 |
| x |
| 44 |
| 8.8g |
| 40 |
| 20g |
| 58.5 |
| z |
| 52.65 |
| 500 |


科目:初中化学 来源: 题型:阅读理解
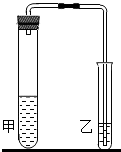 (2012?鼓楼区一模)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
(2012?鼓楼区一模)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.| 碳酸钠+盐酸 | 碳酸氢钠+盐酸 | |
| 实验现象 | ||
| 化学反应方程式 |
温度 溶解度 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com