
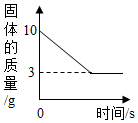
 某同学取Fe粉与Cu粉混合物样品,加入足量的稀盐酸,待反应完全后过滤,称得固体质量如图所示,试计算:
某同学取Fe粉与Cu粉混合物样品,加入足量的稀盐酸,待反应完全后过滤,称得固体质量如图所示,试计算:分析 由于铜在金属活动性顺序中排在氢的后面,不与酸反应,只有铁与盐酸反应,稀盐酸是足量的,所以不溶物为铜的质量,铜的质量为3g;则铁的质量为10g-3g=7g,根据方程式列比例式进行计算,已知量是铁,即可求出氢气的质量.
解答 解:(1)由题意可知,铜的质量为3g;铜的质量分数=$\frac{3g}{10g}$×100%=30%.
(2)铁的质量为:10g-3g=7g;
设生成氢气的质量为x
Fe+2HCl═FeCl2+H2↑
56 2
7g x
$\frac{56}{7g}=\frac{2}{x}$
解得:x=0.25g
答:(1)30%;
(2)产生氢气的质量是0.25g.
点评 解答本题的关键是要知道铜与盐酸不反应,因为铜排在了氢的后面,只有排在氢前面的金属才能与酸反应产生氢气.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
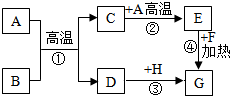 A--H是初中化学常见的物质,已知A为黑色固体单质,G为紫红色固体单质,B为红棕色粉末,F为黑色粉末,它们的转化关系如图所示.请回答.
A--H是初中化学常见的物质,已知A为黑色固体单质,G为紫红色固体单质,B为红棕色粉末,F为黑色粉末,它们的转化关系如图所示.请回答.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
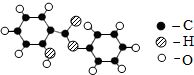 在宏观、微观和符号之间建立联系是化学学科的特点.
在宏观、微观和符号之间建立联系是化学学科的特点.| 物质 | B | C | D | 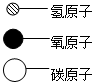 |
微观示意图 |  |  |  |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
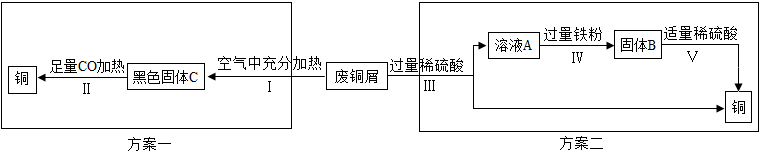
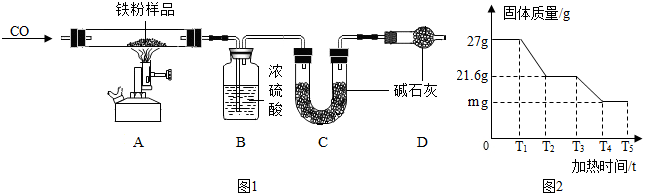
| 反应前(g) | 反应后(g) | |
| B | 100 | 105.4 |
| C | 150 | 163.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com