
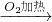 CuO
CuO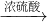 CuSO4
CuSO4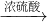 CuSO4(Cu+2H2SO4(浓)
CuSO4(Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O)
CuSO4+SO2↑+2H2O)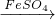 CuSO4
CuSO4

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源:学习周报 化学 沪教课标中考版 2009-2010学年 第13期 总169期 题型:059
化学活动小组的同学在探究金属的化学性质时,发现铜与稀硫酸在常温时和加热的条件下均不反应,并且通过查阅资料获悉:浓硫酸与水混合会放出大量的热.那么,铜与浓硫酸能否发生反应呢?
猜想与假设:
猜想:①在常温下能反应;
②在常温下不能反应,但在加热条件下能反应;
③在加热条件下不能反应.
实验与事实:
操作:①将一小块铜片放入试管中,加入足量的浓硫酸,无明显现象;
②加热该试管,铜片上有气泡产生,并闻到刺激性气味;
③检验产生的有刺激性气味的气体(检验方法及现象均略);
④停止加热;
⑤将试管中的试液慢慢倒入少量水中,溶液呈蓝色.
结论与解释:
(1)由以上探究可知:猜想________是正确的.
(2)经检验产生的气体是SO2,停止加热是为了避免产生更多的SO2.
(3)铜跟浓硫酸在加热条件下反应的产物是SO2和CuSO4两种物质.
反思与评价:
(1)操作⑤中,从安全角度考虑(填“能”或“不能”)________将水倒入试液中.
(2)探究结论中对产物仅是SO2和CuSO4这两种物质的判断是否正确________,理由是________________.
拓展与应用:
根据以上探究和已掌握的知识,同学们又设计了两个利用废铜屑,硫酸等原料制取CuSO4的实验方案.
甲方案:利用废铜屑跟浓硫酸在加热条件下反应制取CuSO4;
乙方案:在加热条件下将废铜在空气中氧化成CuO,再将CuO与稀硫酸反应制CuSO4;请你从安全、节约、环保等方面进行评价,较好的方案是________,理由是(答出一点即可)________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com