
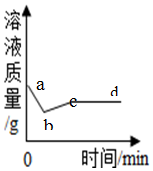
分析 由于氧化钙能与水发生反应生成氢氧化钙,而消耗了饱和溶液中的水,从而使溶液因减少溶剂水而析出固体,饱和石灰水中的溶质、溶剂质量同时减少,即溶液的质量也要减少,故可以据此来完成解答.
解答 解:由于氧化钙与饱和石灰水中的水发生反应而使溶液因此减少了水,饱和石灰水的溶剂减少会造成氢氧化钙析出,溶液的溶质、溶剂都在减少,所以溶液的质量也在减少,氧化钙与水反应放出大量的热,氢氧化钙的溶解度随温度的升高而减小,所以开始反应时,由于温度升高,氢氧化钙的溶解度减小,此时会析出一部分溶质,反应完毕温度慢慢降下来了,氢氧化钙的溶解度又变大了,所以又溶解了一部分氢氧化钙,溶液质量又增加了一部分;由于氧化钙与水反应生成氢氧化钙,饱和石灰水的溶剂减少会造成氢氧化钙析出,溶液的溶质、溶剂都在减少,所以溶液的质量也在减少,所以最后溶液的质量要小于反应前溶液的质量.
故答案为:由于氧化钙与饱和石灰水中的水发生反应而使溶液因此减少了水,饱和石灰水的溶剂减少会造成氢氧化钙析出,溶液的溶质、溶剂都在减少,所以溶液的质量也在减少,氧化钙与水反应放出大量的热,氢氧化钙的溶解度随温度的升高而减小,所以开始反应时,由于温度升高,氢氧化钙的溶解度减小,此时会析出一部分溶质,反应完毕温度慢慢降下来了,氢氧化钙的溶解度又变大了,所以又溶解了一部分氢氧化钙,溶液质量又增加了一部分;由于氧化钙与水反应生成氢氧化钙,饱和石灰水的溶剂减少会造成氢氧化钙析出,溶液的溶质、溶剂都在减少,所以溶液的质量也在减少,所以最后溶液的质量要小于反应前溶液的质量.
点评 全面分析影响饱和溶液的各种因素,是正确处理有关饱和溶液发生改变类问题的关键,可以体现思维的严密性.


科目:初中化学 来源: 题型:选择题
| A. | 金刚石由碳原子构成 | B. | 水蒸发,分子间隙增大 | ||
| C. | 氯化钠晶体由分子构成 | D. | 化学反应前后,原子个数一定不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一氧化碳还原氧化铁时,先加热氧化铁粉末至红热,后通入一氧化碳气体 | |
| B. | 测定溶液的pH,先将试纸用水湿润,后用干净的玻璃棒蘸取待测液点在试纸上 | |
| C. | 稀释浓硫酸时,先在烧杯中倒入水,后将浓硫酸沿烧杯壁缓慢地注入水中,并不断搅拌 | |
| D. | 加热氯酸钾制取氧气时,用排水法收集气体,实验完毕后,先熄灭酒精灯,后将导管从水槽中移出 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钾溶液和稀硫酸混合 | B. | 氧化铝固体粉末加入稀盐酸中 | ||
| C. | 碳酸氢钠溶液和稀盐酸混合 | D. | 二氧化硫气体通入氢氧化钠溶液中 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
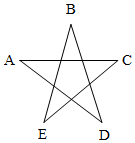 A、B、C、D、E五种物质均为初中化学中常见的化合物,它们之间的反应关系如图所示(两者间连线表示能发生反应).A、C、E均为氧化物,且A、C均常用于灭火,B是人体中胃液的成分,可用于除铁锈,而D溶液可以用来检验A;C和E反应能生成D.
A、B、C、D、E五种物质均为初中化学中常见的化合物,它们之间的反应关系如图所示(两者间连线表示能发生反应).A、C、E均为氧化物,且A、C均常用于灭火,B是人体中胃液的成分,可用于除铁锈,而D溶液可以用来检验A;C和E反应能生成D.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 苯甲酸溶液的pH小于7 | |
| B. | 把锌粒放入苯甲酸溶液中不会产生气泡 | |
| C. | 苯甲酸溶液能与碱发生反应 | |
| D. | 苯甲酸溶液不能使无色酚酞试液变色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 常见的酸溶液:H2O、HCl、H2SO4 | B. | 常见的黑色固体:CuO、MnO2、Fe3O4 | ||
| C. | 常见的还原性物质:C、CO、O2 | D. | 常见的氧化物:MgO、KMnO4、H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 待鉴别的物质 | 鉴别方法 |
| A | 碳粉与氧化铜 | 滴加稀硫酸,观察现象 |
| B | 酒精与白醋 | 闻气味 |
| C | 碳酸钡与氯化钠固体 | 加足量的水,观察是否溶解 |
| D | 稀硫酸与硫酸钠溶液 | 滴加酚酞溶液,观察溶液颜色变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com