
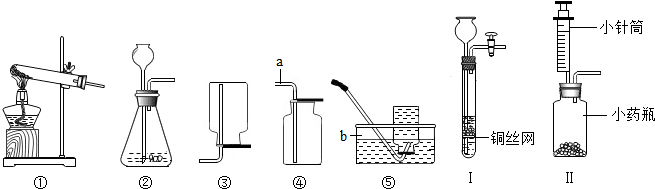
分析 (1)据实验室制取氧气、氢气和二氧化碳的方法并结合装置分析解答;
(2)氯酸钾在加热、二氧化锰作催化剂的条件下生成氯化钾和氧气;
(3)实验室制取二氧化碳用大理石和稀盐酸,铜网上放置固体,铁和稀盐酸会反应生成氢气,导致收集的二氧化碳不纯;装置Ⅱ是一微型实验,可节约药品,并对小针筒、药瓶进行废物利用,并能逐滴加入液体,控制反应速率等;
(4)氯化氢溶于水形成盐酸,盐酸可与硝酸银反应生成不溶于水的氯化银沉淀,所以可用来检验二氧化碳中是否混有氯化氢气体;
(5)氯化铵和氢氧化钙在加热条件下,反应生成氯化钙、水和氨气;氧化钙溶于水能够放出大量的热,并且能和水反应生成氢氧化钙.
解答 解:(1)A、氧气的密度比空气大,不能用向下排空气法收集,故错误;
B、实验室可用双氧水和二氧化锰常温反应制取氧气,可用②,氧气不易溶于水,可用排水法收集,正确;
C、实验室制取二氧化碳用大理石或石灰石和稀盐酸反应,不需加热,可用②,二氧化碳密度比空气大,可用向上排空气法收集,正确;
D、实验室用锌和稀硫酸反应制取氢气,不需加热,可用②,氢气难溶于水,可用排水法收集,正确;
(2)氯酸钾在加热、二氧化锰作催化剂的条件下生成氯化钾和氧气,方程式是:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(3)实验室制取二氧化碳用大理石或石灰石和稀盐酸反应,铜网上放固体,所以放的是大理石或石灰石,若将铜网换成铁网,铁和稀盐酸会反应生成氢气,导致收集的二氧化碳不纯;装置Ⅱ是一微型实验,可节约药品,并对小针筒、药瓶进行废物利用,并能逐滴加入液体,因此可控制反应速率;
(4)要检验二氧化碳气体中的氯化氢气体,应该用硝酸银溶液,氢氧化钠、无色酚酞溶液遇氯化氢无明显现象,二氧化碳和水反应生成碳酸也显酸性,故紫色石蕊溶液无法鉴别,硝酸银与氯化氢反应生成氯化银白色沉淀,可用来鉴别;
(5)加热熟石灰(Ca(OH)2)和氯化铵固体混合物可以生成氨气、氯化钙和水蒸气,反应方程式是,Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
将浓氨水滴加到生石灰快速产生氨气,发生装置最好选用Ⅱ装置,这是因为是将浓氨水滴加到生石灰上,如果利用有长颈漏斗的装置,产生的氨气会从长颈漏斗逸出,而Ⅱ装置中的注射器则克服了这一缺点,且可控制反应速率,得到较平稳的氨气流;
生石灰在反应中的作用是:CaO和水反应减少了溶剂、溶于水放热,降低了氨气的溶解度,使氨水挥发性增强;
故答案为:(1)B C D;
(2)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(3)大理石(或石灰石); 制得的 CO2中混人H2,使气体不纯;节约药品 (或废物利用、可获得平稳的气流、控制反应的速率等);
(4)D;
(5)Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;Ⅱ; CaO和水反应减少了溶剂,且溶于水放热,降低了氨气的溶解度,使氨水的挥发性增强.
点评 本考点主要考查了氧气和氢气、二氧化碳的制取装置和收集装置的选择、装置的评价,同时也考查了化学方程式的书写等知识,综合性比较强,掌握相关知识才能正确解答,能较好考查学生分析、解决问题的能力.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
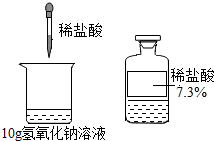 向盛有10g 氢氧化钠溶液(滴有2滴酚酞试液)的烧杯中滴入稀盐酸,恰好完全反应时消耗右图中稀盐酸的质量为10g,回答并计算:
向盛有10g 氢氧化钠溶液(滴有2滴酚酞试液)的烧杯中滴入稀盐酸,恰好完全反应时消耗右图中稀盐酸的质量为10g,回答并计算:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com