
分析 样品中只有碳酸钠和氯化钙溶液反应生成碳酸钙沉淀,所以根据化学方程式计算出碳酸钠的质量,进而计算出碳酸钠的质量分数.
解答 解:设产生1.00g碳酸钙沉淀需要碳酸钠的质量为x.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 1.00g
根据:$\frac{106}{100}=\frac{x}{1.00g}$,解得:x=1.06g,
所以样品中Na2CO3质量分数为:$\frac{1.06g}{11.8g}$×100%≈9%
答:纯碱样品中碳酸钠的质量分数约为9%;
点评 根据化学方程式能表示反应中各物质的质量比,由反应中某种物质的质量可计算出反应中其它物质的质量.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
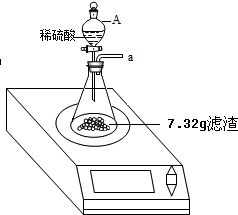 某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 生活中物质之间常常可以相互转化,如图.
生活中物质之间常常可以相互转化,如图.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷燃烧时,会产生大量的白雾 | |
| B. | 铁丝在氧气中剧烈燃烧,生成黑色固体 | |
| C. | 木炭在氧气中燃烧时生成黑色固体 | |
| D. | 硫在氧气中燃烧时,会发出淡蓝色火焰 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
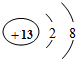 和
和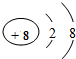 形成的化合物Al2O3.
形成的化合物Al2O3.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 “减少污染、净化空气,还我一片蓝天”,已成为人们共同的心声.
“减少污染、净化空气,还我一片蓝天”,已成为人们共同的心声. ,因为加气站空气中含有天然气,遇到明火,可能会爆炸.
,因为加气站空气中含有天然气,遇到明火,可能会爆炸.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com