
| A. | 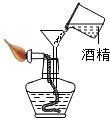 添加酒精 | B. | 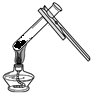 加热固体 | C. | 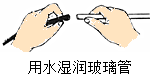 连接导管和胶管 | D. | 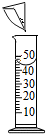 溶解固体 |
分析 A、根据使用酒精灯时的注意事项进行分析.
B、根据加热固体的注意事项进行分析判断.
C、根据连接导管和胶管的方法进行分析判断.
D、根据溶解固体的方法进行分析.
解答 解:A、使用酒精灯时要注意“两查、两禁、一不可”,不能向燃着的酒精灯内添加酒精,图中所示操作错误.
B、给试管中的固体加热,试管口要略向下倾斜,目的是防止水倒流炸裂试管,图中所示操作错误.
C、连接玻璃导管和胶皮管的正确操作是右手玻璃导管用水湿润使其润滑,然后稍稍用力转动插入胶皮导管中;图中所示操作正确.
D、溶解操作应在烧杯中进行,不能用量筒溶解固体,图中所示操作错误.
故选:C.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:实验探究题
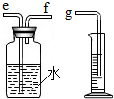 “寒假假期”,小兵对“铁与稀硫酸反应快慢的影响因素”进行了探究.
“寒假假期”,小兵对“铁与稀硫酸反应快慢的影响因素”进行了探究.| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 30% | 锌粒 | 61.7 |
| ④ | 30% | 锌片 | 79.9 |
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
| 实验 编号 | 试剂 | 前10min内产生的 氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL30% | 564.3 |
| b | 含杂质的锌 | 30mL30% | 634.7 |
| c | 纯锌 | 40mL30% | 449.3 |
| d | 纯锌 | 40mL30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
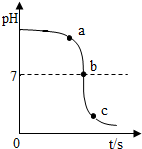 某校化学小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,通过数字化传感器测得烧杯中溶液pH值的变化图象如图所示.下列说法正确的是( )
某校化学小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,通过数字化传感器测得烧杯中溶液pH值的变化图象如图所示.下列说法正确的是( )| A. | 图中a点所示溶液呈酸性 | |
| B. | 图中b点所示溶液中主要含有两种离子 | |
| C. | 图中c点所示溶液中含有的溶质是Na2SO4和NaOH | |
| D. | 该实验是将氢氧化钠溶液逐滴滴入到盛有稀硫酸的烧杯中 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH、CuS04、H2SO4 | B. | NaCl、Na2S04、NaOH | ||
| C. | NaCl、Ba(N03)2、HC1 | D. | NH4N03、NaOH、Na2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 甲、乙同学在学完酸的化学性质后,做了如图所示的实验.请回答下列问题:
甲、乙同学在学完酸的化学性质后,做了如图所示的实验.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将浓硫酸涂在木条上,发现木条变黑,推测浓硫酸具脱水性 | |
| B. | 测定酸雨的pH,发现都小于7,推测pH小于7的雨水都是酸雨 | |
| C. | 二氧化碳能灭火,推测只要发生火灾都可以使用二氧化碳灭火器进行灭火 | |
| D. | 当溶液的溶质形成结晶时,发现溶质的质量减小,推测溶液的浓度也减小 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子在化学反应中可分,则原子在化学反应中也可分 | |
| B. | 水电解产生氢气和氧气,所以水是由氢气和氧气组成的 | |
| C. | 氧化物中一定含有氧元素,但含氧元素的化合物不一定是氧化物 | |
| D. | 二氧化锰是加快过氧化氢分解的催化剂,所以催化剂都能加快化学反应的速率 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 构成它们的原子大小不同 | B. | 构成它们的原子数目不同 | ||
| C. | 构成它们的原子种类不同 | D. | 组成它们的原子排列方式不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com