
| A. | 用天然气作燃料 | B. | 干冰用于人工降雨 | ||
| C. | 用铁制铁锅 | D. | 铝丝用作电线 |
分析 物质的化学性质是指在化学变化中表现出来的性质,物质的物理性质是指不需要通过化学变化表现出来的性质,据此进行分析判断.
解答 解:A、用天然气作燃料,是利用了天然气的可燃性,需要通过化学变化才表现出来,是利用了其化学性质,故选项正确.
B、干冰用于人工降雨,是利用了干冰是升华吸热的性质,不需要发生化学变化就能表现出来,是利用了其物理性质,故选项错误.
C、用铁制铁锅,是利用了铁的导热性,不需要发生化学变化就能表现出来,是利用了其物理性质,故选项错误.
D、铝丝用作电线,利用了铝的导电性,不需要发生化学变化就能表现出来,是利用了其物理性质,故选项错误.
故选A.
点评 本题难度不大,区分物质的用途是利用了物理性质还是化学性质,关键就是看利用的性质是否需要通过化学变化体现出来.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 | |
| B. | 氢氧化钠+硫酸铜→硫酸钠+氢氧化铜 | |
| C. | 锌+稀盐酸→氯化锌+氢气 | |
| D. | 水$\stackrel{通电}{→}$氢气+氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 鱼、虾等能在水中生存,是由于氧气易溶于水 | |
| B. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| C. | 钢铁生锈、食物腐败都是与氧气发生缓慢氧化的结果 | |
| D. | 物质与氧气的反应都是化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.| 实验 编号 | 选用金属 (均取2g) | 盐酸浓度 (均取50 mL) | 每30秒产生气体的体积/mL | |||||
| 30秒 | 30~ 60秒 | 60~ 90秒 | 90~ 120秒 | 120~ 150秒 | 前150秒收 集气体 | |||
| Ⅰ | 锌片 | 10% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
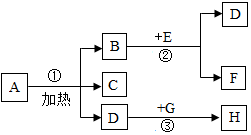 在如图转化关系中,生成物D能使带星的木条复燃,F是一种常见的液体,H能使澄清石灰水变浑浊,在反应②中,B的质量和化学性质均没有改变.
在如图转化关系中,生成物D能使带星的木条复燃,F是一种常见的液体,H能使澄清石灰水变浑浊,在反应②中,B的质量和化学性质均没有改变.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com