实验课上,老师拿出两瓶无标签的溶液,一瓶是过氧化氢溶液,一瓶是水,要求学生鉴别,并帮助贴上标签.
(1)你的鉴别方法是______.
(2)实验室若用34g过氧化氢完全分解,产生氧气的质量为多少克?
小丽的计算方法是:利用化学反应前后元素守恒原理来计算.她分析得出:产生氧气的质量等于过氧化氢中氧元素的质量.
计算如下:34g过氧化氢中氧元素的质量=34g×32/34=32g 所以,氧气的质量为32g
你的另外做法是:______
通过分析你认为小丽的做法是否正确?______,理由______.
【答案】
分析:(1)根据过氧化氢在二氧化锰做催化剂的条件下可以放出氧气进行鉴定;
(2)根据化学方程式进行计算;
(3)根据过氧化氢分解生成水和氧气,过氧化氢中的氧元素并没有全部转化成氧气进行解答.
解答:解:(1)过氧化氢在二氧化锰做催化剂的条件下可以放出氧气,故取样于试管中加入少许二氧化锰,若冒气泡的是过氧化氢溶液,不冒气泡的则是水;
(2)设34g过氧化氢完全分解,产生氧气的质量为x
2H
2O
2
2H
2O+O
2↑
2×34 32
34g x
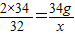
x=16g
(3)因为过氧化氢分解生成水和氧气,过氧化氢中的氧元素并没有全部转化成氧气,故不正确.
故答案为:(1)取样于试管中加入少许二氧化锰,若冒气泡的是过氧化氢溶液,不冒气泡的则是水;
(2)根据化学方程式进行计算;
(3)不正确;过氧化氢的氧元素质量有一部分进入水中,有一部分进入氧气;
点评:本题考查了过氧化氢的鉴别和根据化学方程式的计算,题目较易.

 2H2O+O2↑
2H2O+O2↑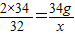


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案