
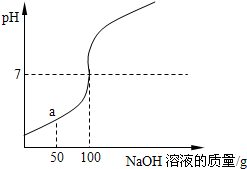
 为测定某稀盐酸溶液溶质额质量分数,取100g该溶液溶于烧杯中,向烧杯中滴入16%的NaOH溶液,用pH计测得滴入NaOH溶液质量与pH的关系如图所示.
为测定某稀盐酸溶液溶质额质量分数,取100g该溶液溶于烧杯中,向烧杯中滴入16%的NaOH溶液,用pH计测得滴入NaOH溶液质量与pH的关系如图所示.分析 (1)由图示可知,滴加氢氧化钠溶液到100克时,氢氧化钠溶液与稀盐酸完全反应,当滴加稀盐酸至图中a点时,稀盐酸还没有完全反应,这时溶液中的溶质就有氯化钠和氯化氢两种.
(2)根据反应的氢氧化钠的质量,利用化学方程式求出反应的盐酸的溶质的质量.进而求出盐酸的质量分数.
解答 解:(1)由图示可知,滴加氢氧化钠溶液到100克时,氢氧化钠溶液与稀盐酸完全反应,当滴加稀盐酸至图中a点时,稀盐酸还没有完全反应,盐酸就有剩余,这时溶液中的溶质就有氯化钠和氯化氢两种.
故答案为:NaCl和HCl;
(2)设100g稀盐酸中含HCl的质量为x
NaOH+HCl═NaCl+H2O
40 36.5
100g×16% x
$\frac{40}{36.5}=\frac{100g×16%}{x}$
x=14.6g
所用稀盐酸的溶质质量分数=$\frac{14.6g}{100g}$×100%=14.6%
答:所用稀盐酸的溶质质量分数为14.6%.
点评 做这类题目要会看折点,折点是指图象在变化过程中方向发生了大的转变的那个点.它的出现往往是两个变量中某一变量单方面停止造成的.如果图象涉及化学反应,折点通常是该反应的结束点.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:初中化学 来源: 题型:解答题
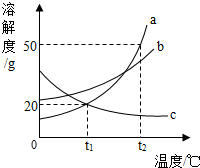 如图是a、b、c三种固体物质的溶解度曲线,请回答下列问题:
如图是a、b、c三种固体物质的溶解度曲线,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 白色粉末中可能有氯化钠和碳酸钙 | |
| B. | 白色粉末中肯定没有氢氧化钠和碳酸氢铵,可能有氯化钠 | |
| C. | 白色粉末中肯定有氯化钡、氢氧化钠、无水硫酸铜和碳酸钙 | |
| D. | 白色粉末中肯定有氢氧化钠和无水硫酸铜,且二者的质量比一定为1:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑤⑥⑦ | C. | ③④⑤ | D. | ③⑤⑥⑦ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论 |
| 先用pH试纸测定稀盐酸的 pH.再逐渐滴加氢氧化钠溶 液.并不断振荡,同时测定 混合液的pH | pH逐渐变大,最后PH≥7 | 稀盐酸与氢氧化钠溶液能发 生反应 |
| 实验步骤 | 实验现象 | 结论 |
| 稀盐酸与氢氧化钠溶液反应 放热. |
| 实验步骤 | 实验现象 | 结论 |
| 取少受上述反应后的溶液子 试管中.滴加硫酸铜溶液. | 若生成蓝色沉淀 | 氢氧化钠溶液过量 |
| 若没有明显现象 | 稀盐酸与氢氧化钠溶液恰好 完全反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 酸溶液能使紫色石蕊试液变红,能使紫色石蕊试液变红的一定是酸 | |
| B. | 氢氧化钠能与二氧化碳反应生成盐和水,所以属于中和反应 | |
| C. | 氧化物有两种元素组成,其中一种元素为氧元素,所以水属于氧化物 | |
| D. | 碱溶液的pH>7,碳酸钠溶液的pH也大于7,所以它属于碱 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
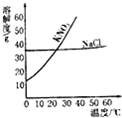 根据给出的KNO3和NaCl两种物质的溶解度表,溶解度曲线,回答问题.
根据给出的KNO3和NaCl两种物质的溶解度表,溶解度曲线,回答问题.| 0 | 20 | 40 | 60 | 80 | 100 | |
| KNO3 | 13.3 | 31.6 | 63.6 | 110 | 169 | 246 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com