
【题目】大黄同学喝“养乐多”时感觉有酸味,他猜测其中有酸。査阅资料大黄同学得知,养乐多含有乳酸。
(提出问题)乳酸是否具有酸的通性?
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
在乳酸溶液中加入石蕊 | 石蕊变红 | 乳酸具有酸的通性 |
在乳酸溶液中加入_____(填化学式) | 有气泡产生,点燃气泡产生爆鸣声 | |
在乳酸溶液中加入碳酸氢钠 | _____ |
(实验反思)(1)从微粒角度看,乳酸具有酸的通性是因为其溶液中存在大量_____;
(2)乳酸化学符号用HL表示,写出乳酸和碳酸氢钠反应的化学方程式_____。
(定量研究)为测定乳酸组成元素和化学式,称取6.0g乳酸放入如图加热装置中(夹持仪器未画出),通入充足氧气使之完全燃烧,将反应后的混合气体先后通过装置B、C.试回答:

(1)为顺利完成实验,将方框内所示装置放入B、C位置时,正确的导管连接顺序是:_____→_____→_____→_____;
(2)按正确方式连接B、C装置进行实验,实验后测得氢氧化钠溶液增重_____g,浓硫酸增重3.6g,则乳酸中碳元素:氢元素质量比=6:1;
(3)已知乳酸相对分子质量是90,则乳酸的化学式为_____。
(反思拓展)乳酸经过聚合反应可以制成聚乳酸塑料[(C3H4O2)n,n>1000],聚乳酸塑料常温下会降解生成CO2和H2O.以下对聚乳酸认识正确的是_____。
A 聚乳酸制成的外卖快餐饭盒,不会产生“白色污染”
B 聚乳酸是一种有机高分子化合物
C 聚乳酸降解发生了分解反应
D聚乳酸中碳元素:氢元素:氧元素质量比=9:1:8
【答案】Fe 产生气泡,气体能使澄清石灰水变浑浊 氢离子 NaHCO3+HL═NaL+H2O+CO2↑ c d a b 8.8 C3H6O3 AB
【解析】
[实验探究]
在乳酸溶液中加入石蕊,溶液变红色,说明溶液显酸性;
在乳酸溶液中加入Fe,有气泡产生,点燃气泡产生爆鸣声,是因为乳酸和铁反应生成乳酸亚铁和氢气,氢气不纯燃烧由爆鸣声;
在乳酸溶液中加入碳酸氢钠,产生气泡,气体能使澄清石灰水变浑浊,是因为乳酸和碳酸氢钠反应生成乳酸钠、水和二氧化碳,实验过程如下所示:
实验步骤 | 实验现象 | 实验结论 |
在乳酸溶液中加入石蕊 | 石蕊变红 | 乳酸具有酸的通性 |
在乳酸溶液中加入Fe | 有气泡产生,点燃气泡产生爆鸣声 | |
在乳酸溶液中加入碳酸氢钠 | 产生气泡,气体能使澄清石灰水变浑浊 |
[实验反思]
(1)从微粒角度看,乳酸具有酸的通性是因为其溶液中存在大量氢离子。故填:氢离子。
(2)乳酸和碳酸氢钠反应的化学方程式:NaHCO3+HL═NaL+H2O+CO2↑。故填:NaHCO3+HL═NaL+H2O+CO2↑。
[定量研究]
(1)该实验通过测量生成水的质量确定原物质中氢元素的质量,通过测定生成二氧化碳的质量确定原物质中碳元素的质量,由于氢氧化钠溶液中有水,故要先测定生成水的质量,后测定生成二氧化碳的质量,并且将生成的气体与吸收气体的浓硫酸和氢氧化钠溶液充分接触,使生成的水和二氧化碳完全吸收,故气体由长管c、a通入,故为顺利完成实验,将方框内所示装置放入B.C位置时,正确的导管连接顺序是:c→d→a→b。
故填:c;d;a;b。
(2)浓硫酸增重3.6g,说明反应生成3.6g水,其中含有氢元素质量为:3.6g×![]() =0.4g,
=0.4g,
乳酸中碳元素:氢元素质量比=6:1,则碳元素质量为:0.4g×6=2.4g,
反应生成二氧化碳质量为:2.4g÷![]() =8.8g,
=8.8g,
实验后测得氢氧化钠溶液增重8.8g。故填:8.8。
(3)乳酸中氧元素质量为:6.0g﹣0.4g﹣2.4g=3.2g,
乳酸中碳原子、氢原子、氧原子个数比为:![]() =1:2:1,设每个乳酸分子中碳原子个数为x,则12x+2x+16x=90,x=3,则氢原子是6个,氧原子是3个,乳酸的化学式为 C3H6O3。故填:C3H6O3。
=1:2:1,设每个乳酸分子中碳原子个数为x,则12x+2x+16x=90,x=3,则氢原子是6个,氧原子是3个,乳酸的化学式为 C3H6O3。故填:C3H6O3。
[反思拓展]
A.聚乳酸制成的外卖快餐饭盒,不会产生“白色污染”,这是因为聚乳酸塑料常温下会降解生成CO2和H2O,该选项说法正确;
B.聚乳酸是一种有机高分子化合物,该选项说法正确;
C.聚乳酸降解时,和氧气反应生成水和二氧化碳,不是分解反应,该选项说法不正确;
D.聚乳酸中碳元素、氢元素、氧元素质量比为:(12×3):(1×6):(16×3)=6:1:8,该选项说法不正确。故填:AB。


科目:初中化学 来源: 题型:
【题目】某研究性学习小组利用下列装置进行气体的制取实验,请分析回答下列问题。
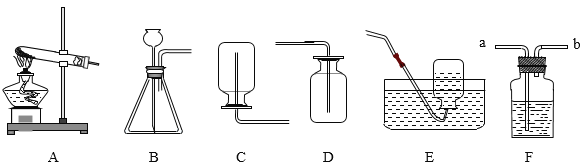
(1)选用A装置制取氧气的化学方程式_____。
(2)A、E连接,制取的氧气不纯的原因是_____(写一点即可)。
(3)实验室制取二氧化碳选择的发生装置和收集装置是_____(填选项字母),选择该发生装置的依据是_____,检验二氧化碳是否收集满的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组同学对家用普通干电池中含有的物质产生了浓厚的兴趣。他们剥开电池时闻到氨味且发现有黑色物质。
【提出问题】为什么有氨味?黑色物质的成分是什么?
【猜想假设】能闻到氨味说明含有铵盐(如NH4Cl);黑色固体可能有铁粉、氧化铜或二氧化锰。
【实验探究】同学们分别设计实验进行探究。
实验I.小聪取适量黑色物质与______________混合置于研钵内研磨,嗅到强烈氨味,再用湿润的红色石蕊试纸检测,观察到试纸变蓝,证明黑色物质中含有铵盐。
实验II.小敏将黑色物质加入适量的水中搅拌溶解,静置后______,取不溶物进行实验。
实验步骤 | 实验现象 | 实验结论 |
1.取适量黑色滤渣装入试管中,再加入过量稀盐酸 | 无气泡生成,溶液不变色 | ________________ |
2.取适量黑色滤渣装入另一支试管中,再加入______溶液,向上述试管中伸入带火星的小木条。 | ____________________________________ | 黑色粉末中含有二氧化锰 |
【交流讨论】
步骤2中发生反应的化学方程式为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】写出下列化学反应方程式
(1)高温煅烧石灰石_____。
(2)稀硫酸与铁锈反应_____。
(3)铜和硝酸银溶液_____。
(4)硫酸铵和氢氧化钠溶液混合共热_____。
(5)小苏打中加入稀盐酸_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化锌(ZnO)可作为紫外线吸收剂应用于化妆品中,其一种生产工艺如下:
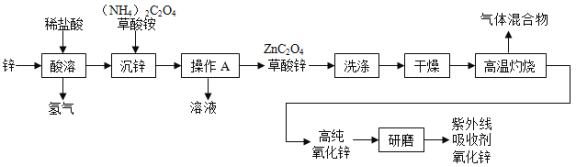
(1)推测草酸的化学式是____________;
(2)“沉锌”过程中发生复分解反应,反应的化学方程式是_______________________________
(3) “操作A”的名称是______________ 实验室常用的研磨仪器是_____________;
(4)“高温灼烧”时草酸锌分解,反应的化学方程式是______________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列装置结合所学的化学知识,回答相关问题:
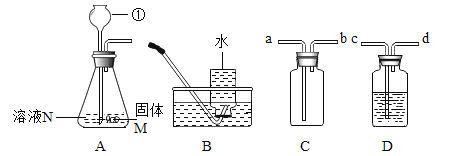
(1)标号①的仪器名称为_____;
(2)若用A装置作为制取氧气的发生装置,则A装置中发生反应的化学方程式为_____,若用C 装置收集氧气,气体应从_____(选填“a”或“b”)口进人。
(3)若用A装置作为制取二氧化碳的发生装置,则固体M和溶液N分别为_____;一般不用B装置收集二氧化碳的原因是_____。收集干燥的CO2还需要用到D装置,D装置中盛装的试剂为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是硝酸钾和氯化钾的溶解度曲线图,回答:
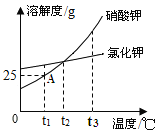
①t1℃时,A溶液中溶质、溶剂的质量比为_____
②t1℃时的KNO3的溶解度_____KCl 的溶解度(填:“大于”、“小于”或“等于”)
③t2℃时,各取100g硝酸钾、氯化钾饱和溶液先各蒸发mg水,过滤,得到硝酸钾溶液a和氯化钾溶液b。再将a、b溶液升温至t3℃时,下列关于a. b溶液的说法正确的是_____
A 都是不饱和溶液 B 溶液质量a>b C 溶液质量a=b D 溶剂质量a<b E 溶质质量分数a=b
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】MgSO4·7H2O 是一种重要的化工原料,在48.1℃以下的潮湿空气中稳定,在温热干燥空气中易失去结晶水.某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO4·7H2O的主要流程如图:

已知:SiO2 既不溶于水也不溶于稀硫酸.请回答下列问题:
(1)“操作 a”的名称是_____.
(2)MgCO3 溶于稀硫酸的化学方程式为_____
(3)流程中获得七水硫酸镁前省略的操作是____、降温结晶、过滤、洗涤和低温烘干.
(4)为什么不直接将溶液C蒸发结晶制备MgSO4·7H2O原因:(用化学方程式表示)_____.
(5)“溶液A”中加入H2SO4溶液会生成Fe2(SO4)2,该反应的化学方程式为_______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶硫酸溶液,老师请小刚同学设计方案测定该溶液的溶质的质量分数。小刚先取一只洁净的小烧杯,称其质量为16.4 g,然后往其中倒入少量硫酸溶液后称量,总质量为30.2 g,之后,将一枚质量为11.8 g的铁钉(已用砂纸打磨去铁锈)放入该小烧杯中,待铁钉表面不再有气泡产生后,再次称量,总质量为41.9 g。请回答下列问题:
(1)反应后产生的气体的质量是______g。
(2)计算该硫酸溶液的溶质的质量分数。(写出计算过程,结果精确到0.1%)_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com