
分析 (1)根据铜的物理性质进行分析判断;
(2)通过计算化合物中铜、氢、碳元素的质量比结合铜绿的化学式进行分析;
(3)①小明得到的红色固体轻,因此一致认为小明的产物中没有Cu2O;
②当得到的全部是铜时b=a×$\frac{64}{80}$=$\frac{4}{5}$a,全部是氧化亚铜时,b=a×$\frac{144}{80×2}$=$\frac{9}{10}$a,从而得到a与b的数量关系;
③根据题中信息Cu2O+H2SO4(稀)═Cu+CuSO4+H2O进行分析.
解答 解:(1)电气工业上常用铜作电缆的内芯,是利用铜具有良好的导电性,故填:导电;
(2)铜元素的质量为(22.2g-1.8g-4.4g)×$\frac{64}{80}$=12.8g,氢元素的质量为1.8g×$\frac{2}{18}$=0.2g,碳元素的质量为4.4g×$\frac{12}{44}$=1.2g,铜原子和氢原子、碳原子的个数比为$\frac{12.8g}{64}$:$\frac{0.2g}{1}$:$\frac{1.2g}{12}$=2:2:1,结合“铜绿”[化学式:Cux(OH)yCO3]可知,x=2,y=2,铜在潮湿的空气中生成铜绿(Cu2(OH)2CO3)是铜与空气中的水、氧气、二氧化碳共同作用的结果.故答案为:2;2;2Cu+CO2+O2+H2O═Cu2(OH)2CO3;
(3)①小明得到的红色固体轻,因此一致认为小明的产物中没有Cu2O,故填:小明;
②当得到的全部是铜时b=a×$\frac{64}{80}$=$\frac{4}{5}$a,全部是氧化亚铜时,b=a×$\frac{144}{80×2}$=$\frac{9}{10}$a,若红色固体为Cu和Cu2O的混合物,则a与b的数量关系是$\frac{4}{5}$a<b<$\frac{9}{10}$a;
③根据题中信息Cu2O+H2SO4(稀)═Cu+CuSO4+H2O可知,可向红色固体中加入少量稀硫酸,若溶液变蓝色,则证明红色固体中含有Cu2O,故填:可向红色固体中加入少量稀硫酸,若溶液变蓝色,则证明红色固体中含有Cu2O.
点评 此题难度太大,掌握金属的性质、化学性质的有关计算以及根据题中信息解决问题的能力等即可顺利解答.


科目:初中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>Z>X | C. | Y>X>Z | D. | Z>Y>X |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 羊毛纤维和合成纤维(点燃,再闻气味) | |
| B. | 蒸馏水与食盐水(看颜色) | |
| C. | 稀盐酸与氢氧化钠溶液(加酚酞试液,看颜色) | |
| D. | 白酒和食醋(闻气味) |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
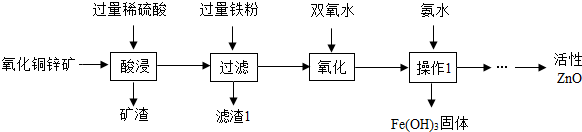
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com