
| A.硬度比生铁高 | B.在潮湿的空气中放置不生锈 |
| C.能与硫酸铜反应 | D.能与稀盐酸反应 |


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:初中化学 来源:不详 题型:单选题
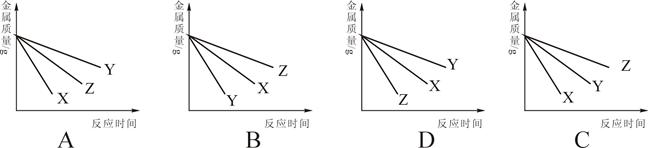
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.滤渣中一定有Fe粉 | B.滤渣中一定有Cu粉 |
| C.滤液中一定有Fe2+ | D.滤液中一定有Ag+、Cu2+ |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.不能用铁桶盛放硫酸铜溶液 |
| B.铁钉在干燥的空气中不易生锈 |
| C.铁是地壳中含量最多的金属元素 |
| D.稀硫酸和氯化钠溶液存在时都会加速铁的锈蚀 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
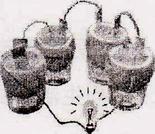
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.滤出的固体中一定含有铜 | B.滤出的固体一定含有铁 |
| C.滤液中一定含有硫酸锌 | D.滤液中可能含有硫酸铜 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.Ag、Cu、Mg | B.Cu、Mg、Zn |
| C.Ag、Cu、Zn | D.Ag、Mg、Zn |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.若混合物为Fe、Al,m可能是0.2g |
| B.若混合物为Fe、Zn,m不可能是0.2g |
| C.若混合物为Fe、Zn,m可能是0.1g,则该混合物中铁的质量分数为50% |
| D.若混合物为Fe、A1,则稀盐酸中溶质质量分数一定大于7.3% |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题


A.2Cu+ O2 2CuO 2CuO |
B.2Cu+O2+2H2SO4 2CuSO4+2H2O 2CuSO4+2H2O |
C.Cu + H2SO4  CuSO4 + H2 ↑ CuSO4 + H2 ↑ |
D.CuO + H2SO4  CuSO4 + H2O CuSO4 + H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com