
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
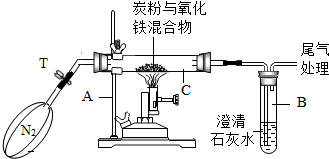 某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:
某化学兴趣小组的学生研究过量的炭粉与Fe2O3在高温条件下反应的气体产物成分.探究过程如下:| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 | 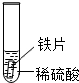 | 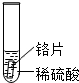 | 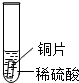 |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 铜表面无气泡 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
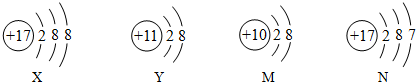
| A. | 以上四种粒子分别属于三种元素 | |
| B. | 粒子Y若得到1个电子就可以变成原子 | |
| C. | 如果X和Y能形成稳定的化合物,则化学式应为XY | |
| D. | 上述粒子中有两个是离子,两个是原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 研究性学习小组进行“影响过氧化氢生成O2快慢的有关因素”的课题探究.以下是他们探究的主要过程:
研究性学习小组进行“影响过氧化氢生成O2快慢的有关因素”的课题探究.以下是他们探究的主要过程:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com