
| 实验操作 | 实验现象 | 实验结论 |
| (a)取少量样品溶于水,加入 过量的氯化钙溶液; | 有白色沉淀产生 | 该反应的化学方程式为 Na2CO3+CaCl2═CaCO3↓+2NaCl |
| (b)静置,向将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅱ成立 |

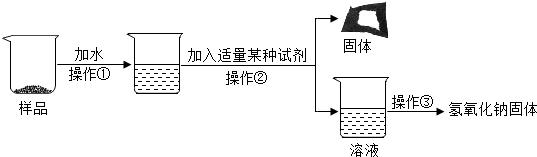
分析 【提出猜想】氢氧化钠变质是与二氧化碳反应生成碳酸钠和水;
【实验探究1】根据碳酸钠溶液与氯化钙溶液反应生成了碳酸钙和氯化钠,其中碳酸钙为固体,而氯化钠为中性溶液,所以为了确认氢氧化钠是否存在,应该加入过量的氯化钡溶液,然后再取上层清液,加入酚酞溶液进行判断即可;
【实验探究2】(1)做实验时连接好仪器一定要检查装置的气密性.
(2)根据实验目的“通过测二氧化碳的体积来计算药品中碳酸钠的含量”进行分析,
(3)根据二氧化碳在空气中的含量分析;
(4)量筒中收集到饱和二氧化碳水溶液220mL即为反应生成的二氧化碳的体积,由此,生成二氧化碳的质量为:220 mL/1000×1.8 g/L=0.396 g.根据二氧化碳的质量及反应的化学方程式便可求出碳酸钠的质量,就能得出样品中碳酸钠的质量分数.
【实验探究3】(1)根据操作的特点分析;玻璃棒加速溶解;
(2)根据除去氢氧化钠中的碳酸钠方法分析;
(3)根据由方程式分析;
【实验反思】(1)根据实验步骤分析;
(2)根据实验目的分析.
解答 解:【提出猜想】氢氧化钠变质是与二氧化碳反应生成碳酸钠和水;反应方程式为:CO2+2NaOH=Na2CO3+H2O.
【实验探究1】氯化钙溶液和碳酸钠反应生成白色沉淀碳酸钙和氯化钠,所以若观察到产生了白色沉淀,则说明在该固体中含有碳酸钠,该反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
碳酸钠被完全反应后,若溶液能够使酚酞溶液变红,则说明溶液呈碱性,从而可以判断该溶液中含有氢氧化钠,则猜想Ⅲ成立;若酚酞试液没有变红,说明不含有氢氧化钠,则猜想Ⅱ成立;
【实验探究2】(3)做有气体参与的连续性实验的一般步骤是,连接装置→检验装置气密性→装药品→做实验.
(4)本题的实验目的是通过测二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳可以溶于水,所以用饱和的碳酸氢钠水溶液,可以避免二氧化碳的减少.
(5)空气中含有的二氧化碳量很少,不会对结果产生大的影响;
(6)解:生成二氧化碳的质量为:$\frac{220}{1000}$×1.8 g/L=0.396 g
设样品中含碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 0.396g
$\frac{106}{x}=\frac{44}{0.396g}$
解之得:x=0.954g
∴样品中碳酸钠的质量分数=$\frac{0.954g}{2g}$×100%≈48%
【实验探究3】(7)操作①的名称为溶解、②的名称为过滤、③的名称为蒸发,为了使样品充分溶解,可用玻璃棒搅拌;
(8)碳酸钠能与石灰水反应生成碳酸钙沉淀和氢氧化钠,能除去杂质且没有引入新的杂质,方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(9)根据反应看出,变质生成的碳酸钠通过反应生成氢氧化钠,最终所得氢氧化钠固体质量比变质后样品中氢氧化钠的质量多.
【实验反思】(10)敞口放置的氢氧化钠溶液容易变质,所以试剂瓶要用橡皮塞密封保存;
(11)定性检验氢氧化钠的变质要选择试剂种类、注意实验装置与步骤的计划;定量测定变质样品中某成分的含量时要确定试剂用量,实验中还要考虑实验安全环保问题、测量中减少误差问题.
(12)检验中将碳酸钠转化为氯化钠,以排除对氢氧化钠检验的干扰;除杂中是将碳酸钠转化为产品氢氧化钠.
故答案为:【提出猜想】CO2+2NaOH=Na2CO3+H2O.
【实验探究1】
| 实验操作 | 实验现象 | 实验结论 |
| a.取少量样品溶于水,加入过量的氯化钙溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
| b.将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅱ成立 |
点评 熟练掌握碳酸钠、碳酸钙等碳酸盐和氢氧化钠、氧化钙的化学性质,能根据所给的实验或者自己设计实验来验证它们是否变质,并熟练的写出相应的化学方程式.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H+ Ba2+ NO3- SO42- | B. | H+ NO3- Cl- Ca2+ | ||
| C. | K+ Mg2+ NO3- Cl- | D. | K+ Na+ Mg2+ SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 高温煅烧石灰石可制得生石灰 | |
| B. | 将草木灰(含K2CO3)与氯化铵混合施用 | |
| C. | 纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产 | |
| D. | 用石灰乳与硫酸铜溶液混合配制防治植物病害的波尔多液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO | O2 | 通过灼热的铜网后收集气体 |
| B | 铁粉 | 铜粉 | 加入足量的稀硫酸,过滤 |
| C | KCl晶体 | K2CO3 | 加入稍过量的稀盐酸,蒸发结晶 |
| D | K2CO3固体 | CaCO3 | 加水充分溶解,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH、CuSO4、H2SO4 | B. | NaCl、Na2SO4、NaOH | ||
| C. | NaCl、Ba(NO3)2、HCl | D. | NH4NO3、NaOH、Na2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 试管:同学们不爱惜我,我被摔碎了 | |
| B. | 铁钉:好难受啊,我在潮湿空气中生锈了 | |
| C. | 灯泡:我通电后发光了,给学生带来光明 | |
| D. | 蜡烛:我受热就会熔化,遇冷我又会凝固 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com