
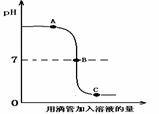
盐酸和氢氧化钠溶液(滴有酚酞试液)发生反应过程中溶液的pH变化如下右图。下列有关该实验事实的说法错误的是( )
A.该实验是将盐酸滴入氢氧化钠溶液中
B.B点表示盐酸和氢氧化钠恰好完全反应
C.B点和C点时,溶液均呈现无色
D.滴加硝酸银溶液,可证明发生了中和反应
科目:初中化学 来源: 题型:阅读理解
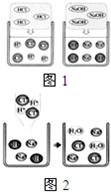 (2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.
(2011?乌鲁木齐)在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾”四种物质的溶液对“复分解反应发生的条件”进行再探究.查看答案和解析>>
科目:初中化学 来源: 题型:
21、下列关于化学实验的“目的-操作-现象-结论”的描述不正确的是( )
|
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?怀柔区一模)酸、碱溶液是化学常见的物质,依据所给内容回答问题:
(2013?怀柔区一模)酸、碱溶液是化学常见的物质,依据所给内容回答问题:| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31 | 91 | 111 | 129 | 313 | 336 |
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com