
| 溶解度 |
| 溶解度+100g |
| 33g |
| 33g+100g |
| S |
| S+100g |


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:阅读理解
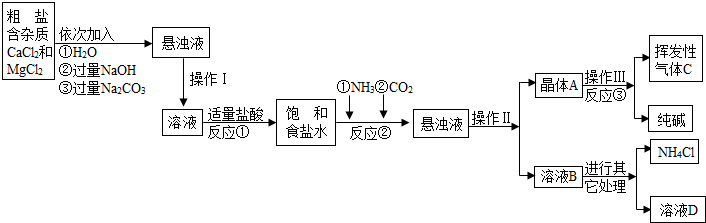
| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 工业纯碱标准:(Na2CO3≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?平江区二模)请写出下列相关的化学反应方程式并完成题后填空:
(2013?平江区二模)请写出下列相关的化学反应方程式并完成题后填空:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com