
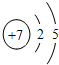 已知浓硝酸是一种易挥发的强酸,见光易分解,其分解的反应方程式为:4HNO3
已知浓硝酸是一种易挥发的强酸,见光易分解,其分解的反应方程式为:4HNO3 2H2O+4NO2↑+X↑.根据上述信息,回答下列问题:
2H2O+4NO2↑+X↑.根据上述信息,回答下列问题: 2H2O+4NO2↑+X↑.反应前4HNO3中含H、N、O原子个数分别为4、4、12,而反应后2H2O、4NO2中共含有H、N、O原子个数分别为4、4、10,结合质量守恒定律的实质:反应前后原子种类、个数不变,可判断X分子由2个O原子构成,则物质X的化学式为O2;
2H2O+4NO2↑+X↑.反应前4HNO3中含H、N、O原子个数分别为4、4、12,而反应后2H2O、4NO2中共含有H、N、O原子个数分别为4、4、10,结合质量守恒定律的实质:反应前后原子种类、个数不变,可判断X分子由2个O原子构成,则物质X的化学式为O2;

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
 已知浓硝酸是一种易挥发的强酸,见光易分解.其分解的反应方程式为:
已知浓硝酸是一种易挥发的强酸,见光易分解.其分解的反应方程式为:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
 已知浓硝酸是一种易挥发的强酸,见光易分解,其分解的反应方程式为:
已知浓硝酸是一种易挥发的强酸,见光易分解,其分解的反应方程式为:
| ||
. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com