
 33、学习酸碱中和反应时,很多同学对其产生探究兴趣.
33、学习酸碱中和反应时,很多同学对其产生探究兴趣.

科目:初中化学 来源: 题型:
 (2010?宿迁)学习酸碱中和反应时,很多同学对其产生探究兴趣.
(2010?宿迁)学习酸碱中和反应时,很多同学对其产生探究兴趣.查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?浦东新区二模)在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验.
(2012?浦东新区二模)在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验.查看答案和解析>>
科目:初中化学 来源: 题型:
学习酸碱中和反应时,很多同学对其产生探究兴趣。
(1)甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。乙同学认为甲同学的推理不合理,理由是________________ __。
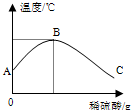
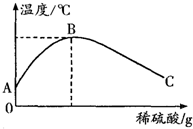
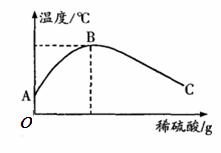
(2)乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,氢氧化钠溶液的温度随着加入的稀硫酸质量的变化曲线如下图所示:
①由该图知,稀硫酸与氢氧化钠溶液发生的
反应是____ ___ (填“放热”或“吸
热”)反应,B点表示的含义是______________。
②A→B,烧杯中溶液的pH逐渐____________。
③B→C,烧杯内溶液中含有的阳离子有________(填离子符号)。
(3)丙同学将稀硫酸滴入氢氧化钠溶液中,有气
泡产生,他认为氢氧化钠溶液已变质。请你分析
变质的原因(用化学方程式表示)_____________ ____。
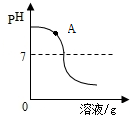
(4)丁同学认为氢氧化钠溶液与稀硫酸混合没有明显现象,于是他想借助下列溶液来验证反应是否真的发生,你觉得不可行的是________________________。
A.无色酚酞试液 B.FeCl3 C.BaCl2 D.KNO3
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验.
在学习酸碱中和反应时,同学们做了稀硫酸和氢氧化钠溶液反应的实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com